уровень гемоглобина при рождении
Уровень гемоглобина при рождении
Гемопоэз — процесс, который поддерживает продукцию гемопоэтических клеток крови на протяжении всей жизни. Основным местом гемопоэза у плода является печень, в то время как на протяжении всей постнатальной жизни — костный мозг.
Все гемопоэтические клетки образуются из полипотентных гемопоэтических стволовых клеток, которые являются ключевыми для нормального кровообразования; при их дефиците происходит недостаточность костного мозга, поскольку стволовые клетки требуются для продолжающегося замещения погибающих клеток.
Число полипотентных стволовых клеток остаётся относительно постоянным на протяжении всей жизни, поскольку пул стволовых клеток поддерживается балансом между пролиферацией стволовых клеток и дифференциацией в более зрелые гемопоэтические клетки всех гемопоэтических линий дифференцировки. Гемопоэтические стволовые клетки от здоровых доноров используются для лечения детей с недостаточностью костного мозга (трансплантация стволовых клеток).
Продукция гемоглобина у плода и новорождённого
Наиболее важное различие между гемопоэзом у плода по сравнению с постнатальной жизнью заключается в изменении принципа продукции Hb на каждой стадии развития. Первая формируемая глобиновая цепь — е-глобин, который практически немедленно дополняется а- и у-глобинами, которые экспрессируются с 4-5 нед гестации.
Фетальный Hb (HbF) состоит из 2а- и 2у-цепей (2а2у) и является основным Нb в течение внутриутробной жизни. У него более высокая аффинность к кислороду, чем у Hb взрослого человека (HbA), которая позволяет ему экстрагировать и удерживать кислород, что является преимуществом в относительно гипоксической окружающей среде плода.
Типы Hb у новорождённого, появившегося в срок: HbF, HbA и HbA2. HbF постепенно замещается HbA в течение первого года жизни. HbF и эмбриональный Hb в норме не определяются после периода младенчества, однако они продуцируются при врождённых нарушениях продукции Hb (гемоглобинопатиях) и определение их помогает в диагностике этих заболеваний.
Гематологические показатели при рождении и в первые несколько недель жизни:
• При рождении Hb у младенцев, рождённых в срок, высокий, 14-21,5 г/дл, для того чтобы компенсировать низкую концентрацию кислорода у плода. Hb падает в первые несколько недель в основном за счёт сниженного эритропоэза, уровень которого достигает самого низшего уровня вплоть до 10 г/дл в возрасте 2 мес. Нормальные гематологические показатели при рождении и в детстве представлены в приложении.
• У недоношенных младенцев отмечается более крутое снижение Hb — в среднем до 6,5-9,0 г/дл в первые 4-8 нед календарного возраста.
• Нормальный объём крови при рождении варьирует в зависимости от гестационного возраста. У здоровых младенцев средний объём крови — 80 мл/кг, у недоношенных — 100 мл/кг.
• Запасы железа, фолиевой кислоты и витамина В12 у доношенных и недоношенных младенцев достаточные при рождении. Однако у недоношенных младенцев запасы железа и фолиевой кислоты ниже и снижаются быстрее, что приводит к недостаточности после 2-4 мес, если не осуществляется рекомендованный ежедневный приём.
• Количество лейкоцитов у новорождённых выше, чем у старших детей (10-25х109/л).
• Количество тромбоцитов при рождении находится в пределах нормальных показателей взрослого возраста (150-400х109/л).
Гемоглобин при рождении:
• Концентрация Hb при рождении высокая (>14 г/дл), однако снижается до минимального уровня в возрасте 2 мес.
• HbF постепенно замещается НЬА в младенческом возрасте.
Примечание. Hb — гемоглобин; НbА — гемоглобин взрослого человека; HbF — фетальный гемоглобин.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Анализ крови у детей и прививки
Поделиться:
Клинический анализ крови в РФ входит в стандарт обследования перед вакцинацией. Мое мнение, что чаще всего он совершенно не нужен, если например ребенок с виду здоров и никаких жалоб нет. Тем не менее анализ сдают и нередко трактуют результаты совершенно неадекватно.
Многие лаборатории банально «забивают» на тот факт, что интерпретация результатов анализа крови у ребенка имеет свои особенности. И просто пишут анализы на стандартных бланках, где рядом с результатами анализа в столбике напечатаны «нормы». Но с этими нормами детские показатели сравнивать нельзя!
О детских нормах гемоглобина
Сколько нервотрепки доставляют родителям эти бланки с «отклонениями» от нормы! Сколько тревожных звонков и писем обрушивается на педиатра! Я и мои коллеги ежедневно вынуждены развеивать страхи родителей, которые пытаются самостоятельно оценить полученные анализы своих детей.
Например, гемоглобин. У взрослых его норма составляет от 120 до 150 г/л. У детей же все сложнее. Если сразу после рождения «нормальный» гемоглобин составляет 180–220 г/л, то уже к 2–3 месяцам жизни его уровень стремительно падает до нижней границы нормы, которая начинается от 90 г/л. Это так называемая физиологическая анемия. И поскольку это норма, лечить ее не надо.
Читайте также:
Таблетки для гемоглобина
Тем не менее этот факт почему-то всеми дружно забывается, и вот двухмесячному ребенку с очень неплохим для его возраста уровнем гемоглобина 105 г/л ставится диагноз анемия.
Медотвод от прививок
И ладно если бы все дело ограничилось только назначением препаратов железа. Но некоторые мои коллеги почему-то обожают в этой ситуации назначать медотвод от вакцинации. Мол, человек ослаблен, с прививкой надо повременить.
Читайте также:
Вакцина от коклюша
Но, во-первых, анемии нет, смотрим нормы выше. (Для окончательного решения можно сдать дополнительные анализы.)
Во-вторых, если разобраться, вакцина нам нужна для чего? Чтобы пациента защитить. А кто наиболее подвержен заболеванию? У кого будет протекать инфекция тяжелее? Правильно, у ослабленного. Получается, что даже если у пациента и есть легкая анемия, это не является противопоказанием к вакцинации. Наоборот, ослабленных пациентов нужно прививать в первую очередь.
О детских нормах лейкоцитов
Вообще, благодаря определению концентрации в крови лейкоцитов можно решить, какая у пациента инфекция — бактериальная (если повышены) или вирусная (если понижены). А соответственно, нужен антибиотик или нет.
У взрослых людей содержание лейкоцитов в норме колеблется от 4 до 9 тысяч в мкл. Но у детей опять все по-другому. Так, при рождении верхняя граница нормы лейкоцитов может достигать 30–34 тысяч в мкл, до года содержание лейкоцитов — от 5 до 18 тысяч в мкл, после года — от 4 до 12 тысяч в мкл. И это все — ЗДОРОВЫЕ дети.
Лейкоцитарная формула
Кроме лейкоцитов в лаборатории могут посчитать количество нейтрофилов (палочкоядерных и сегментоядерных) и лимфоцитов. Повышенное содержание нейтрофилов (нейтрофилез) часто свидетельствует о бактериальной инфекции, лимфоцитоз — о вирусной.
У взрослых в норме больше нейтрофилов, чем лимфоцитов. У детей опять же все сложнее. Сразу после рождения лимфоцитов меньше, чем нейтрофилов, как и у взрослого человека. Но уже на пятый день жизни возникает так называемый «первый перекрест», когда количество нейтрофилов становится равным лимфоцитам.
Сразу после этого количество лимфоцитов начинает расти и в норме остается выше, чем содержание нейтрофилов, вплоть до 4–5 лет жизни, когда возникает «второй перекрест». И это не лимфоцитоз, это норма. После 5 лет ситуация меняется и количество лимфоцитов снова начинает уступать нейтрофилам, как и у взрослых людей.
Детская доброкачественная нейтропения
Отдельно остановлюсь на одном отклонении от нормы в анализе крови, при котором снижается количество нейтрофилов. Это так называемая доброкачественная нейтропения детского возраста. В норме у детей до года нейтрофилов должно быть больше 1000 в мкл, после года — больше 1,5 тысяч. Но бывает, что нейтрофилов оказывается «ощутимо» меньше.
Встречается этот феномен очень часто, но клинически себя никак не проявляет. Несмотря на то что нейтрофилы отвечают за сопротивление бактериальным инфекциям, их в организме человека всегда «с запасом», поэтому такое снижение никак не отражается на здоровье.
Безусловно, для дифференциального диагноза с другими нейтропениями может потребоваться осмотр гематолога. Но если диагноз доброкачественной нейтропении подтверждается, то никаких ограничений нет, лечение не требуется.
Тем не менее и эту особенность детского анализа крови зачем-то используют для того, чтобы отсрочить вакцинацию. Хотя опять же возвращаясь к вышесказанному: кого нужно защитить в первую очередь? Ослабленных, со сниженным иммунитетом. А значит, пациентов с доброкачественной нейтропенией нужно прививать в первую очередь, по крайней мере инактивированными вакцинами.
Что нужно знать о детском гемоглобине (2021-03-19 17:07:58)
Что нужно знать о детском гемоглобине
Уровень гемоглобина в крови ребенка – очень важный показатель. Он позволяет вовремя обнаружить нарушения в работе внутренних органов. Чтобы держать эти данные под контролем, родителям надо знать, каковы допустимые отклонения от нормы.
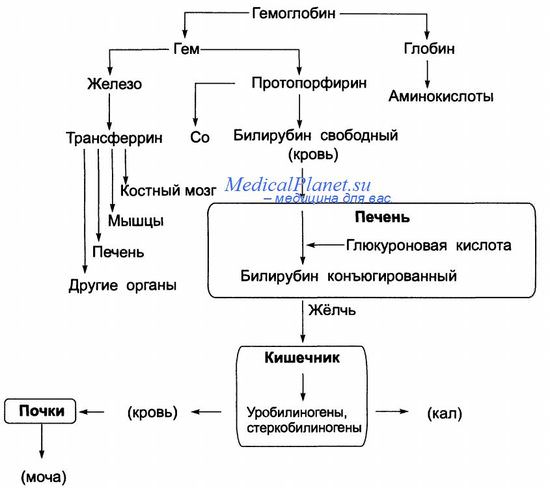
Гемоглобином называется сложный железосодержащий белок в составе эритроцитов. Это один из важнейших элементов крови, так как он доставляет кислород из легких во все ткани растущего организма крохи, на обратном пути участвует в переносе углекислого газа, а также поддерживает кислотно-щелочной баланс в организме. Содержащиеся в гемоглобине атомы железа делают кровь красной. Современная медицина различает 2 вида гемоглобина: гликолизированный, в состав которого входит глюкоза, и фетальный, который характерен только для новорожденных.
При сдаче общего анализа крови в 1, 3, 6 месяцев и в 1 год обязательно проверяют уровень гемоглобина. Если после года выявляется его фетальная форма, это может свидетельствовать о развитии заболеваний крови.
Возрастная норма
Уровень гемоглобина в крови ребенка во многом зависит от возраста крохи, так как по мере взросления малыша его потребности в кислороде меняются. Фетальный гемоглобин к году полностью выводится из организма. Его заменяет гликолизированный «собрат».
Уровень гемоглобина в крови новорожденных – 145–220 г/л, к месяцу он падает до 110–200 г/л, в 1–2 месяца составляет 110–180 г/л, в 2–6 месяцев – 115–140 г/л, с 6 месяцев до 2 лет – 115–135 г/л, в возрасте от 2 до 6 лет – 115–135 г/л. После года, если нет проблем со здоровьем, педиатры рекомендуют контролировать уровень гемоглобина раз в год.
Проблемы дефицита
Чаще всего проблемы у детей возникают из-за низкого содержания гемоглобина, причиной которого становится нехватка железа. В этом случае ставится диагноз «железодефицитная анемия». Организм испытывает недостаток кислорода, из-за чего есть риск отставания в физическом и умственном развитии, увеличивается вероятность подхватить инфекцию, могут появиться и неполадки в работе сердца.
Бледная кожа, бескровные губы, ломкие ногти, сухая кожа, болезненные трещинки в уголках рта, беспричинные повышения температуры до 37–37,5 °С – таковы самые заметные симптомы неблагополучия. Ребенка надо обязательно показать педиатру и сдать общий анализ крови. Так как снижение уровня гемоглобина в крови могут спровоцировать глисты, инфекции, аутоиммунные недуги, проблемы в работе органов желудочно-кишечного тракта, может потребоваться консультация соответствующих узких специалистов.
Снижению уровня гемоглобина способствует и гиподинамия. Анемичному ребенку надо как можно больше, пока он не устанет, двигаться и играть на свежем воздухе. Врачи рекомендуют таким детям две двухчасовые прогулки в день.
Если серьезных нарушений нет, уровень гемоглобина повысят продукты, богатые железом. Например, говяжий язык, говяжья печень, свекла, яблоки в сочетании с приемом фолиевой кислоты и витаминов С и группы В.
Ненужные излишки
Сигналом к срочному врачебному обследованию становится и повышенный уровень гемоглобина. Доктора в этом случае подозревают серьезные заболевания крови, вызванные неполадками в работе сердечно-сосудистой системы. Избыток гемоглобина может говорить также и о повышенной вязкости крови. Последнее обстоятельство увеличивает риск появления кровяных сгустков (тромбов). Малыш в таком случае бывает сонливым, быстро утомляется, кожа у него краснеет.
При высоком уровне гемоглобина рекомендуется сдать анализ крови повторно. В идеале надо проделать это рано утром, так как после активных игр на воздухе и физических нагрузок этот показатель увеличивается.
Но обычно излишек гемоглобина возникает из-за того, что ребенка перекармливают мясом и дают мало жидкости. Потому прежде всего надо резко ограничить потребление продуктов, богатых железом. Например, вместо мяса есть сою и рыбу, увеличить в меню малыша долю молочных продуктов. Они богаты кальцием, который затрудняет усвоение организмом железа, необходимого для синтеза гемоглобина. Кроме того, очень важно обеспечить крохе обильное питье.
Железодефицитная анемия у детей грудного и младшего возраста
Анемию и анемический синдром, вызываемый многими причинами, можно упомянуть среди наиболее часто встречающихся патологических состояний, с которыми ежедневно приходится сталкиваться педиатрам общей практики. В эту группу входят различные заболевания
Анемию и анемический синдром, вызываемый многими причинами, можно упомянуть среди наиболее часто встречающихся патологических состояний, с которыми ежедневно приходится сталкиваться педиатрам общей практики. В эту группу входят различные заболевания и патологические состояния, характеризующиеся уменьшением содержания гемоглобина и/или эритроцитов в единице объема крови, приводящие к нарушению снабжения тканей кислородом. Применяются следующие лабораторные критерии анемии (Н. П. Шабалов, 2003). В зависимости от возраста детей уровень гемоглобина составляет:
Физиологические потери железа с мочой, потом, калом, через кожу, волосы и ногти не зависят от пола и составляют 1–2 мг в сутки, у женщин во время менструации — 2–3 мг в сутки. У детей потеря железа составляет 0,1–0,3 мг в сутки, возрастая до 0,5–1,0 мг в сутки у подростков.
Ежедневная потребность детского организма в железе составляет 0,5–1,2 мг в сутки. У детей раннего возраста в связи с быстрыми темпами роста и развития наблюдается повышенная потребность в железе. В этот период жизни запасы железа быстро истощаются из-за усиленного его потребления из депо: у недоношенных детей к 3-му месяцу, у доношенных — к 5–6-му мес жизни. Для обеспечения нормального развития ребенка в суточном рационе новорожденного должно содержаться 1,5 мг железа, а у ребенка 1–3 лет — не менее 10 мг.
Дефицит железа у детей приводит к росту инфекционной заболеваемости органов дыхания и ЖКТ. Железо необходимо для нормального функционирования структур головного мозга, при его недостаточном содержании нарушается нервно-психическое развитие ребенка. Установлено, что у детей, имевших в младенчестве железодефицитную анемию, в возрасте 3–4 лет определяются нарушения передачи нервных импульсов от центров головного мозга к органам слуха и зрения из-за нарушения миелинизации и, как следствие этого, нарушение проводимости нервов.
Причины железодефицитных состояний у детей очень разнообразны. Основной причиной ЖДА у новорожденных считается наличие ЖДА или скрытого дефицита железа у матери во время беременности. К антенатальным причинам относят также и осложненное течение беременности, нарушение маточно-плацентарного кровообращения, фетоматеринские и фетоплацентарные кровотечения, синдром фетальной трансфузии при многоплодной беременности. Интранатальными причинами дефицита железа являются: фетоплацентарная трансфузия, преждевременная или поздняя перевязка пуповины, интранатальные кровотечения из-за травматических акушерских пособий или аномалий развития плаценты или пуповины. Среди постнатальных причин сидеропенических состояний на первое место выступает недостаточное поступление железа с пищей. При этом более всего страдают новорожденные, находящиеся на искусственном вскармливании неадаптированными молочными смесями, коровьим и козьим молоком. Другими постнатальными причинами ЖДА являются: повышенная потребность организма в железе; потери железа, превышающие физиологические; заболевания ЖКТ, синдром нарушенного кишечного всасывания; дефицит запасов железа при рождении; анатомические врожденные аномалии (дивертикул Меккеля, полипозы кишечника); употребление продуктов, тормозящих абсорбцию железа.
В группе риска всегда находятся недоношенные дети и дети, родившиеся с очень большой массой, дети с лимфатико-гипопластическим типом конституции.
У детей первого года жизни к дефициту железа чаще всего приводит несбалансированная диета, в частности вскармливание исключительно молоком, вегетарианство, недостаточное употребление мясных продуктов.
К сидеропении способны приводить кровотечения различной этиологии. Источником этого могут быть: грыжа пищеводного отверстия диафрагмы, варикозное расширение вен пищевода, желудочно-кишечные язвы, опухоли, дивертикулы, язвенный колит, геморроидальные узлы, а также кровотечения из мочеполового тракта и дыхательных путей. Прием некоторых медикаментов, таких как нестероидные противовоспалительные препараты, салицилаты, кумарины, глюкокортикостероиды, также может привести к потере железа. Дефицит железа всегда сопутствует заболеваниям, сопровождающимся нарушениями кишечного всасывания (энтериты, болезнь Крона, паразитарные инвазии и др.). Дисбактериоз кишечника также препятствует нормальному перевариванию пищи и тем самым снижает способность организма усваивать железо. Кроме того, может иметь место нарушение транспорта железа из-за недостаточной активности и снижения содержания трансферрина в организме.
Распознать причину развития ЖДА в каждом конкретном случае чрезвычайно важно. Ориентация на нозологическую диагностику необходима, так как в большинстве случаев при лечении анемии можно воздействовать и на основной патологический процесс.
ЖДА проявляется общими симптомами. Один из главных и видимых признаков — бледность кожных покровов, слизистых оболочек, конъюнктив глаз. Обращают на себя внимание общая вялость, капризность, плаксивость, легкая возбудимость детей, снижение общего тонуса организма, потливость, отсутствие или снижение аппетита, поверхностный сон, срыгивание, рвота после кормления, понижение остроты зрения. Выявляются изменения со стороны мышечной системы: ребенок с трудом преодолевает физические нагрузки, отмечается слабость, утомляемость. У детей первого года жизни может наблюдаться регресс моторных навыков.
Во втором полугодии жизни и у детей старше года наблюдаются признаки поражения эпителиальной ткани — шершавость, сухость кожи, ангулярный стоматит, болезненные трещины в уголках рта, глоссит или атрофия слизистой оболочки ротовой полости, ломкость и тусклость волос, их выпадение, матовость и ломкость ногтей, разрушение зубов (кариес), отставание в физическом и психомоторном развитии.
Диагноз ЖДА ставится на основании клинической картины, лабораторных признаков анемии и дефицита железа в организме: гипохромная (цветовой показатель 3+ (мальтофер, мальтофер фол, феррум лек). Эти соединения имеют большую молекулярную массу, что затрудняет их диффузию через мембрану слизистой кишечника. Они поступают из кишечника в кровь в результате активного всасывания. Это объясняет невозможность передозировки препаратов в отличие от солевых соединений железа, всасывание которых происходит по градиенту концентрации. Взаимодействия их с компонентами пищи и лекарственными препаратами не происходит, что позволяет использовать неионные соединения железа, не нарушая режим питания и терапии сопутствующей патологии. Их применение существенно снижает частоту развития побочных эффектов, обычно наблюдаемых при назначении пероральных препаратов железа (тошнота, рвота, диарея, запоры и др.). Кроме того, у детей раннего возраста большое значение имеет лекарственная форма препарата. В этом возрасте удобно использовать капли и сиропы, что обеспечивает в том числе возможность точного дозирования препаратов и не вызывает негативного отношения ребенка.
При назначении любых препаратов железа необходимо рассчитывать индивидуальную потребность в нем для каждого пациента, исходя из того, что оптимальная суточная доза элементарного железа составляет 4–6 мг/кг. Среднесуточная доза железа при лечении ЖДА составляет 5 мг/кг. Применение более высоких доз не имеет смысла, поскольку объем всасывания железа не увеличивается.
Применение парентеральных препаратов железа показано для быстрого достижения эффекта при анемии тяжелой степени; патологии ЖКТ, сочетающейся с нарушением всасывания; неспецифическом язвенном колите; хроническом энтероколите; при тяжелой непереносимости оральных форм препаратов. На сегодняшний день в Российской Федерации для внутривенного введения разрешен только один препарат — венофер (сахарат железа), для внутримышечного может использоваться феррум лек.
Необходимо помнить, что у детей раннего возраста дефицит железа никогда не бывает изолированным и часто сочетается с недостаточностью витаминов С, В12, В6, РР, А, Е, фолиевой кислоты, цинка, меди и др. Это связано с тем, что алиментарная недостаточность и нарушенное кишечное всасывание, приводящие к дефициту железа, влияют и на насыщаемость данными микронутриентами. Поэтому в комплексную терапию ЖДА необходимо включать поливитаминные препараты.
Об эффективности терапии ЖДА можно судить уже через 7–10 дней по увеличению ретикулоцитов в 2 раза по сравнению с исходным количеством (так называемый ретикулоцитарный криз). Также оценивается прирост гемоглобина, который должен составлять 10 г/л и более в неделю. Соответственно, достижение целевого уровня гемоглобина наблюдается в среднем через 3–5 нед от начала терапии в зависимости от тяжести анемии. Однако лечение препаратами железа должно проводиться в достаточных дозах и длительно (не менее 3 мес) даже после нормализации уровня гемоглобина, с тем чтобы пополнить запасы железа в депо.
Если же в течение 3–4 нед не наблюдается значимого улучшения показателей гемоглобина, то необходимо выяснить, почему лечение оказалось неэффективным. Наиболее часто речь идет: о неадекватной дозе препарата железа; продолжающейся или неустановленной кровопотере; наличии хронических воспалительных заболеваний или новообразований; сопутствующем дефиците витамина В12; неверном диагнозе; глистной инвазии и других паразитарных инфекциях.
Противопоказаниями к назначению препаратов железа являются:
При развитии тяжелых анемий, сопровождаемых угнетением эритропоэза и снижением продукции эритропоэтина, показано назначение препаратов рекомбинантного человеческого эритропоэтина (рчЭПО). Особое значение имеет применение рчЭПО при развитии ранней анемии недоношенных, которая развивается на втором месяце жизни и встречается, по данным различных авторов, в 20–90% случаев. Назначение препаратов рчЭПО (рекормон, эпрекс, эпокрин) приводит к резкой активизации эритропоэза и, как следствие, к значительному возрастанию потребностей в железе.
Поэтому применение рчЭПО является показанием к назначению препаратов железа, как правило, парентеральных. В настоящее время в Российской Федерации разрешены к применению a- и b-эпоэтины, которые вошли в список дополнительного лекарственного обеспечения. Назначeние рчЭПО позволяет в большинстве случаев избежать гемотрансфузий, при которых велика вероятность осложнений (трансфузионные реакции, сенсибилизация и пр.). Предпочтительным способом введения препаратов рчЭПО, особенно в раннем детском возрасте, является подкожный. Подкожный способ введения более безопасный и экономичный, так как для достижения эффекта необходимы меньшие дозы, чем при внутривенном введении. До недавнего времени в странах Евросоюза и в Российской Федерации для лечения гипорегенераторных анемий у детей использовались в основном β-эритропоэтины, которые при подкожном введении не вызывали значимых побочных реакций в отличие от a-эритропоэтинов, при подкожном введении которых был велик риск развития красноклеточной аплазии. Наиболее широкое распространение среди β-эритропоэтинов получил препарат рекормон (Ф. Хоффманн-Ля Рош), который удобен в применении и приводит к быстрому повышению уровня эритроцитов и ретикулоцитов, не влияя на лейкопоэз, повышает уровень гемоглобина, а также скорость включения железа в клетки.
С 2004 г. в европейских странах разрешено подкожное введение a-эритропоэтинов, среди которых в нашей стране наиболее часто используются эпрекс (Янсен-Силаг) и эпокрин (Сотекс-ГосНИИ ОЧБ).
Целью лечения рчЭПО является достижение показателей гематокрита 30–35% и устранение необходимости переливаний крови. Значения целевой концентрации гемоглобина могут варьировать в зависимости от дней и месяцев жизни ребенка, однако не могут быть ниже 100–110 г/л. В зависимости от дозы целевые значения концентрации гемоглобина и гематокрита достигаются примерно через 8–16 нед лечения рчЭПО.
С целью профилактики ЖДА рчЭПО назначается недоношенным новорожденным, родившимся с массой тела 750–1500 г до 34-й недели беременности.
Лечение эритропоэтином должно начинаться как можно раньше и продолжаться 6 нед. Препарат рекормон вводят подкожно в дозе 250 МЕ/кг 3 раза в неделю. Однако необходимо учитывать, что чем меньше возраст ребенка, тем более высокие дозы эритропоэтина ему требуются, поэтому доза может быть увеличена.
Как было сказано выше, терапия рчЭПО приводит к резкому возрастанию потребления железа, поэтому в большинстве случаев, особенно у недоношенных детей, одновременно с повышением гематокрита снижается содержание ферритина в сыворотке. Быстрое расходование запасов железа в организме может привести к ЖДА. Поэтому всем больным, получающим терапию рчЭПО, показано назначение препаратов железа. Терапия препаратами железа должна продолжаться до нормализации уровня сывороточного ферритина (не менее 100 мкг/мл) и насыщения трансферрина (не менее 20%). Если концентрация ферритина в сыворотке сохраняется стойко ниже 100 мкг/мл или есть другие признаки дефицита железа, дозу железа следует увеличить, в том числе с использованием парентеральных препаратов.
Профилактика ЖДА у детей раннего возраста включает в себя: антенатальную (правильный режим и питание беременной, своевременное выявление и лечение анемии беременной, превентивное назначение препаратов железа женщинам из групп риска по развитию ЖДА); постнатальную (соблюдение гигиенических условий жизни ребенка, длительное грудное вскармливание и своевременное введение прикормов, адекватный выбор смеси для детей, находящихся на смешанном и искусственном вскармливании, профилактика развития у ребенка рахита, гипотрофии и ОРВИ). В профилактическом назначении препаратов железа нуждаются:
Профилактическое назначение препаратов железа показано детям из групп риска по развитию ЖДА:
Доза железа, назначаемого с профилактической целью, зависит от степени недоношенности ребенка:
Значимость проблемы ЖДА у детей раннего возраста обусловлена ее большой распространенностью в популяции и частым развитием при различных заболеваниях, что требует постоянной настороженности врачей любых специальностей. Тем не менее на современном этапе в арсенале врача имеется достаточно диагностических и лечебных возможностей для раннего выявления и своевременной коррекции сидеропенических состояний.
Литература
Л. А. Анастасевич, кандидат медицинских наук
А. В. Малкоч, кандидат медицинских наук
РГМУ, Москва

 Читайте также:
Читайте также: 
