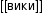Что это такое ch3coona
Ацетат натрия
| Ацетат натрия | |
 | |
| Общие | |
|---|---|
| Систематическое наименование | sodium acetate (ИЮПАК) sodium ethanoate (систематическое) ацетат натрия натрия этаноат |
| Химическая формула | CH3COONa |
| Эмпирическая формула | C2H3O2Na |
| Физические свойства | |
| Состояние (ст. усл.) | белый гигроскопичный порошок |
| Молярная масса | 82.03 грамм/моль (безводная форма) 136.08 грамм/моль (тригидрат) г/моль |
| Плотность | 1,45 г/см³ |
| Термические свойства | |
| Температура разложения | 324 °C |
| Удельная теплота плавления | 264—289 к Дж/кг |
| Химические свойства | |
| Растворимость в воде | 76 г/100 мл |
Ацетат натрия CH3COONa, — натриевая соль уксусной кислоты, производится и широко применяется в промышленных масштабах.
Содержание
Область применения
Ацетат натрия используется в текстильном производстве для нейтрализации отработанной серной кислоты в сточных водах и как фоторезист при использовании анилиновых красителей. Также используется при дублении солями хрома (для протравливания), и замедляет процесс вулканизации хлоропрена при производстве синтетических резин.
Ацетат натрия известен как пищевая добавка E262 и применяется как консервант.
В растворе ацетат натрия (будучи солью слабой кислоты) и уксусная кислота могут применяться как буфер, для сохранения относительно постоянного pH. Это особенно полезно в биохимии в pH-зависимых реакциях.
На этом свойстве основан довольно красивый опыт — «горячий лёд»
Способы получения
Ацетат натрия недорог и его легче приобрести в хим. магазинах, чем синтезировать в лабораторных условиях. В лабораторных условиях получается при взаимодействии уксусной кислоты, например, с карбонатом натрия, гидрокарбонатом натрия или гидроксидом натрия.
Это — хорошо известная реакция «гашения» пищевой соды и винного уксуса, происходящая в тесте. 84 грамма гидрокарбоната натрия реагируют с 750 граммами 8 % винного уксуса (или же с 86 граммами 70 % уксусной эссенции) с образованием 82 грамм ацетата натрия в растворе. Выпариванием воды можно получить чистый кристаллический ацетат натрия или его концентрированный раствор.
Характерные реакции
Ацетат натрия может быть использован для образования эфира с алкил галогенидами такими как бромэтан:
При сильном нагревании (более 324 °C) ацетат натрия разлагается на карбонат натрия и ацетон:
Одновременно может проходить разложение до оксида натрия, ацетона и диоксида углерода:
Галерея
Химический обогреватель, содержащий перенасыщенный раствор ацетата натрия, выделяющего тепло при фазовом переходе в кристаллическую форму тригидрата ацетата натрия.
ацетат натрия что это такое?
Ацетат натрия CH3COONa, — натриевая соль уксусной кислоты.
Ацетат натрия используется в текстильном производстве. Известен как пищевая добавка E262, и применяется как консервант.
Ацетат натрия предотвращает замерзание бетонной смеси при транспортировке, кладке и уплотнении, а так же до начала активной тепловой обработки ( электроподогрев, греющая опалубка, инфракрасный подогрев и др. ) или при термосном выдерживании до устройства теплоизоляции.
Ацетат натрия:
— Не влияет отрицательно на процесс схватывания бетонной смеси;
— Не снижает марку бетона по морозостойкости;
— Не приводит к ухудшению структуры бетона, а так же не усложняет приготовление, транспортировку и укладку бетонной смеси;
— Начало схватывания бетонной смеси колеблется пределах 80-120 минут;
— Не вызывает коррозию арматуры в бетонах;
— Нарастание прочности с УКН при твердении при отрицательных температурах составляет в 28-дневном возрасте от 25,4 до 46,5 от марочной прочности для тяжёлого бетона и от 62% до 80,7% для лёгкого керамзитобетона, что соответствует требованиям нормативной документации.
— Обратим Ваше внимание, что для тяжёлого бетона прочность бетона возрастает с увеличением процента введения ацетата натрия в количестве от 2-3,5%. Наибольший прирост прочности для керамзитобетона при введении ацетата натрия в кол-ве 2% от массы цемента.
— Обладает пластифицирующим эффектом (5-7%)
— Улучшает удобоукладываемость бетонной смеси
http://www.familyhome.by/antifrising_agent/12.html.
Описание
Ацетаты натрия CH3COONa, — натриевые соли уксусной кислоты. Зарегистрированы в качестве пищевой добавки E-262.
Применение ацетатов натрия
Ацетат натрия известен как пищевая добавка E-262, и применяется как консервант.
Будучи солью слабой кислоты, в растворе ацетат натрия и уксусная кислота могут применяться как буфер, для сохранения относительно постоянного pH. Это особенно полезно в биохимии в pH-зависимых реакциях.
Получают ацетат натрия взаимодействием NaOH или Na2CO3 с уксусной кислотой или ее эфирами, при сухой перегонке древесины с Na2CO3 и др.
Применение ацетатов натрия E-262
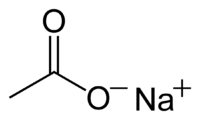
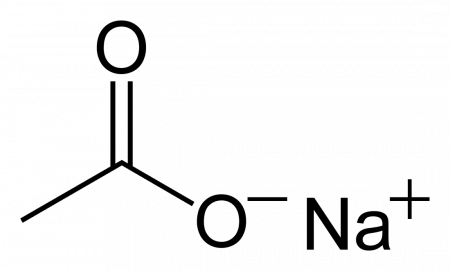
Ацетат натрия
| Ацетат натрия | |
|---|---|
 | |
| Систематическое наименование | sodium acetate (ИЮПАК) sodium ethanoate (систематическое) ацетат натрия натрия этаноат натрий уксуснокислый |
| Хим. формула | C2H3O2Na |
| Рац. формула | CH3COONa |
| Состояние | белый гигроскопичный порошок |
| Молярная масса | 82.03 грамм/моль (безводная форма) 136.08 грамм/моль (тригидрат) г/моль |
| Плотность | 1,45 г/см³ |
| Температура | |
| • плавления | 328 °C |
| • разложения | 324 °C |
| Удельная теплота плавления | 264—289 кДж/кг |
| Растворимость | |
| • в воде | 76 г/100 мл |
| Рег. номер CAS | 127-09-3 |
| PubChem | 517045 |
| Рег. номер EINECS | 204-823-8 |
| SMILES | |
| Кодекс Алиментариус | E262 |
| ChEBI | 32954 |
| ChemSpider | 29105 |
| Токсичность | ирритант, малотоксичен |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
Ацетат натрия CH3COONa, — натриевая соль уксусной кислоты, кристаллы со слабым солёным вкусом и уксусным запахом, производится и применяется в промышленных масштабах.
Содержание
Область применения
Ацетат натрия используется в текстильном производстве для нейтрализации отработанной серной кислоты в сточных водах и как фоторезист при использовании анилиновых красителей. Также используется при дублении солями хрома (для протравливания), и замедляет процесс вулканизации хлоропрена при производстве синтетических резин.
Ацетат натрия известен как пищевая добавка E262 и применяется как консервант.
Также ацетат натрия является источником углерода для бактерий, выращиваемых на питательной среде.
В растворе ацетат натрия (будучи солью слабой кислоты) и уксусная кислота могут применяться как буфер, для сохранения относительно постоянного pH. Это особенно полезно в биохимии в pH-зависимых реакциях.
Ацетат натрия также используется в быту как составная химических грелок (англ. heating pad ) или химических обогревателей (англ. Hand warmer ), применяется как составная часть смеси «горячего льда» (англ. «hot ice» ), при кристаллизации ацетата натрия выделяется тепло — это экзотермический процесс. При нагреве тригидрата ацетата натрия (имеющего точку плавления в 58 °C) до 100 °C (обычно ёмкость с ним кладут в кипящую воду) он расплавляется (вернее, растворяется в собственной кристаллизационной воде) и переходит в водный раствор ацетата натрия. При охлаждении этого раствора образуется перенасыщенный раствор ацетата натрия в воде. Этот раствор прекрасно переохлаждается до комнатной температуры без образования твёрдой фазы, затем нажатием на металлический диск в ёмкости образуется центр кристаллизации, который, вырастая, заставляет перенасыщенный раствор переходить в твёрдую фазу тригидрата ацетата натрия. Этот процесс сопровождается значительным выделением тепла (экзотермическая реакция), теплота фазового перехода составляет 264-289 кДж/кг.
На этом свойстве основан довольно красивый химический опыт — «горячий лёд».
Способы получения
Это — хорошо известная реакция «гашения» пищевой соды и винного уксуса, происходящая в тесте. 84 г гидрокарбоната натрия реагируют с 750 г 8%-го винного уксуса (или же с 86 г 70%-й уксусной эссенции) с образованием 82 г ацетата натрия в растворе. Выпариванием воды можно получить чистый кристаллический ацетат натрия. Для получения тригидрата ацетата натрия без выпаривания необходимо смешать 84 г гидрокарбоната натрия (пищевой соды) с 86 г 70%-ной уксусной кислоты и 10 г воды.
Характерные реакции
Ацетат натрия может быть использован для образования сложного эфира по реакции с алкилгалогенидами, такими как, например, бромэтан:
При сильном нагревании (более 324 °C) ацетат натрия разлагается на карбонат натрия и ацетон:
2CH3COONa → Na2CO3 + (CH3)2CO
Влияние на организм
Ацетат натрия может всасываться в организм при проглатывании. Является ирритантом. LD50 25956 мг/кг. По другим данным из того же источника: LD50(крысы, орально): 3500 мг/кг, LD50(мыши, орально): 4960 мг/кг.
Натрий уксуснокислый — реактив, востребованный промышленностью в больших количествах
Натрий уксуснокислый (ацетат натрия, натрия этаноат) — органическое соединение, соль уксусной кислоты, традиционно называемая ацетатом. Формула CH3COONa или C2H3O2Na. 
Кристаллическое вещество с гигроскопичными кристаллами белого, светло-желтого, желтого, коричневого цвета; со слабым запахом уксуса. Водорастворимое, плохо растворяется в спиртах и эфирах.
Процесс кристаллизации экзотермический. При нагревании ацетат натрия разлагается с образованием ацетона и углекислого натрия. Считается малотоксичным, огне- и взрывобезопасен. Взаимодействует с кислотами. Реакция с серной кислотой приводит к образованию нерастворимого осадка — это свойство используется для нейтрализации серной кислоты. Образует сложные эфиры.
 |  |
| Натрий уксуснокислый (ацетат) б/в | Натрий уксуснокислый 3-вод. (ацетат) |
«Горячий лед», который используется в бытовых химических грелках, — это 3-водный ацетат натрия. Он плавится при температуре +58 °С. При помещении грелки в кипяток, вещество становится жидким, сохраняя это состояние и при комнатной температуре. Для начала процесса кристаллизации достаточно нажать на небольшой металлический диск внутри грелки. Он становится центром кристаллизации и запускает процесс. По мере кристаллизации реактива выделяется значительное количество тепла. Тепло выделяется до тех пор, пока все вещество внутри грелки не станет твердым (поэтому и называют — «горячий лед»). Чтобы вернуть грелку в исходное состояние, ее нужно опять прокипятить в воде, чтобы расплавить содержимое.
Натрия Ацетат
Химическое название
Натриевая соль уксусной кислоты, натрия этаноат.
Химические свойства
Белый гигроскопичный мелкий порошок, растворимый в воде. Разлагается при 324 градусах Цельсия. Молекулярная масса = 82 грамма на моль для безводной формы, 136,1 грамм на моль – для тригидрата. Формула Натрия Ацетата: CH3COONa; рацемическая формула: C2H3O2Na; формула тригидрата: C2H3O2Na х 3H2O.
Химические свойства
Вещество можно получить с помощью реакции уксусной кислоты с карбонатом или гидрокарбонатом натрия, с NaOH. В домашних условиях — это реакция винного уксуса с пищевой содой, к 1 грамму соды добавляют 9 грамм уксуса.
Реакция электролиза Ацетата Натрия. Во время превращения происходит диссоциация CH3COONa до CH3COO- и Na+. У анода выделяется этан и углекислый газ. Далее углекислый газ вступает в реакцию с гидроксидом бария или натрия (NaOH), во втором случаев пробирке останется чистый этан.
Достаточно популярна в химии реакция гидролиза Ацетата Натрия. Для наглядности, образованную слабой к-ой и сильным основанием соль, смешивают с индикатором-фенолфталеином. Смесь нагревают, при этом соль частично плавится и в расплаве появляются гидроксид-ионы. Затем пробирку охлаждают, соль кристаллизуется, и смесь утрачивает фиолетовую окраску. Соединение также реагирует с алкилгалогенидами, бромэтаном с образованием сложных эфиров.
Качественная реакция на Ацетат Натрия проводится в два этапа. Сначала определяют наличие в соединении ионов Na, а затем – кислотного ацетат-остатка. Натрий будет гореть ярко желтым пламенем, если небольшое количество раствора (или сухого вещ-ва) внести в пламя спиртовой горелки. Качественную реакцию на ацетат ион можно провести с помощью любой растворимой соли трехвалентного железа. Раствор станет красно-коричневого цвета, а при нагревании выпадет темно-коричневый осадок Fe(OH)3.
Химическое соединение используют при производстве текстиля; в качестве фоторезиста после применения анилиновых красителей; при вулканизации и в кожевенном производстве. Вещество получило широкое применение в виде пищевой добавки E262, используется в качестве консерванта; его применяют для сохранения стабильного рН в биохимии. Соединение используют при производстве химических обогревателей и грелок, («горячий лёд»). В медицине также используют тригидрат Натрия Ацетата.
Фармакологическое действие
Восстанавливает водно-солевой баланс.
Фармакодинамика и фармакокинетика
Натрия Ацетат применяют в комбинации с другими хим. соединениями. Вещество используют для дезинтоксикации и регидратации. Средство обладает способностью восстанавливать водный и электролитный баланс во время обезвоживания. Стимулирует диурез и предотвращает развитие метаболического ацидоза. Обладает дезинтоксикационным, регидратирующим и плазмозамещающим действием.
Показания к применению
Применяется при регидратации, интоксикации, гиперкалиемии, обезвоживании у пациентов с пищевыми инфекциями, холерой, острой дизентерией и так далее.
Противопоказания
Побочные действия
Редко при применении растворов для внутривенного введения с данным лекарственным средством возникает отечность, тахикардия, озноб.
Инструкция по применению (Способ и дозировка)
Натрия Ацетат в составе различных препаратов для внутривенного введения применяется в условиях стационара, под контролем лабораторных показателей. Растворы вводят струйно или капельно. Дозировка зависит от состояния пациента и тяжести состояния. Как правило, если пациент находится в тяжелом состоянии, то сначала вводят лекарство струйно, затем переходят на инфузии.
Передозировка
Нет сведений о передозировке средством.
Взаимодействие
Вещество часто применяют в комбинации с другими электролитами.
Ацетат Натрия можно сочетать с натрия хлоридом и натрием фумаровокислым, при этом необходимо визуально следить за совместимостью растворов.
Условия продажи
Может потребоваться рецепт.
Особые указания
Лечение препаратом проводят под контролем уровня электролитов крови и гематокрита.