Что такое чтка в кардиологии расшифровка
Что такое чтка в кардиологии расшифровка
При хроническом течении ишемической болезни сердца основным методом лечения считается медикаментозный. Наряду с ним используют методы механической реваскуляризации, однако они ни в коем случае не заменяют постоянной симптоматической терапии и борьбы с факторами риска.
Чрескожная транслюминальная коронарная ангиопластика (ЧТКА).
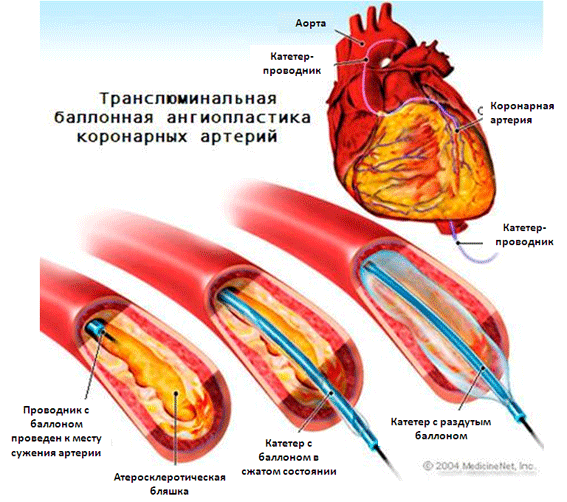
Методика заключается в следующем. После того как гибкий проводник продвигают в венечную артерию через место стеноза, подлежащего дилатации, через него проводят миниатюрный баллончик и устанавливают в месте стеноза. Затем баллончик повторно раздувают до тех пор, пока степень стеноза не уменьшится или он не будет ликвидирован. Совершенствование техники ЧТКА, разработка новых проводящих катетеров, управляемых наконечников, баллончиков-проводников небольшого размера, применение высокого давления при раздувании баллончика позволят уменьшить возможность развития осложнений при ЧТКА, достигать более дистальных стенозов, проводить дилатацию более сложных сужений в венечных артериях.
Чрескожная транслюминальная коронарная ангиопластика (ЧТКА) : Показания и отбор больных.
Чрескожная транслюминальная коронарная ангиопластика (ЧТКА) : Риск.
Чрескожная транслюминальная коронарная ангиопластика (ЧТКА) : Эффективность.
Если у больного в течение первого года после ангиопластики не развился рестеноз или не появились приступы стенокардии, вероятность сохранения достигнутого успеха в течение последующих 4 лет очень высока. При возникновении рестеноза вероятность успешной дилатации при повторной ангиопластике выше, чем при первичной процедуре.
Отмечается, что у 15-30 % больных с клинически выраженной ишемической болезнью сердца, нуждающихся в проведении реваскуляризации, может быть проведена успешная ЧТКА, что позволит избежать операции аортокоронарного шунтирования. Удачно выполненная ЧТКА менее травматична, чем операция аортокоронарного шунтирования, проведение ее гораздо дешевле и требует госпитализации всего на 2-3 дня. Все это позволяет существенно снизить стоимость медицинского обслуживания. Удачная ЧТКА позволяет также быстрее вернуться к трудовой деятельности и возобновить привычную жизненную активность.
Лечение стенокардии : Хирургия венечных артерий (ХВА).
Показания к проведению ХВА основываются на тяжести симптомов и степени поражения венечных артерий, функции левого желудочка. Идеальным кандидатом для проведения ХВА является больной моложе 70 лет без сопутствующих заболеваний с выраженными симптомами ишемической болезни сердца, существенно ограничивающими его жизненную активность и не поддающимися адекватному контролю с помощью медикаментозной терапии, желающий вести более активный образ, жизни, имеющий выраженные стенозы в нескольких эпикардиальных венечных артериях и объективные признаки ишемии миокарда во время возникновения приступов стенокардии. У таких больных можно ожидать значительного улучшения состояния после проведения операции. Если у больного нарушена функция левого желудочка, операция может продлить ему жизнь.
Стентирование коронарной артерии (ЧКВ или PTCA)
Показания для выполнения чрескожного коронарного вмешательства у больных с бессимптомной ишемической болезнью сердца и стабильной стенокардией
пациенты, не получающие лечение по поводу диабета, с бессимптомной ишемией или стенокардией I функционального класса, имеющие ≥ 1 значительных стеноза в 1-2 коронарных артериях, доступных для ангиопластики, у которых высока вероятность успешного результата и низкий риск осложнений (смерти). Сосуд, который планируется дилатировать должен кровоснабжать значительную массу жизнеспособного миокарда.
те же клинические и анатомические критерии, что для класса І, за исключением того, что сосуд кровоснабжает среднюю массу миокарда или пациент имеет диабет, требующий лечения.
пациенты с бессимптомной ишемией или стенокардией I функционального класса, имеющие 2-3 стеноза коронарных артерий, доступных для чрескожного коронарного вмешательства, высокую вероятность успешной дилатации и низкий риск осложнений. Стенозированные сосуды, которые планируется дилатировать, должны кровоснабжать по крайней мере умеренную по величине массу жизнеспособного миокарда. Должны быть объективные свидетельства ишемии миокарда по данным нагрузочного теста с электрокардиографией, суточного мониторирования электрокардиограммы, радиоизотопного или ультразвукового исследования.
пациенты с бессимптомной ишемической болезнью сердца или стенокардией I функционального класса, у которых отсутствуют критерии, перечисленные для классов І и ІІ, и которые имеют:
— небольшую массу ишемизированного миокарда;
— отсутствуют объективные признаки ишемии миокарда;
— стенозы имеют низкую вероятность успешной дилатации;
— незначительные боли в грудной клетке, маловероятно вызванные ишемией миокарда;
— факторы, обуславливающие высокую частоту осложнений (высокую заболеваемость и смертность);
— незначительные стенозы коронарных артерий
Что такое чтка в кардиологии расшифровка
Хирургические методы лечения ИБС имеют своей целью прямое увеличение коронарного кровотока – реваскуляризацию миокарда.
Транслюминальная баллонная ангиопластика (ТЛБАП) – операция, позволяющая восстановить кровоток в артериях сердца (коронарных артериях) путём проведения катетера с баллоном и последующем его раздуванием. Операция ТЛБАП сопровождалась высоким риском осложнений в виде повторного сужения сосуда – рестеноза, острых окклюзий. В современной эндоваскулярной хирургии ТЛБАП выполняется вместе с эндопротезированием венечных (коронарных) артерий, т.е. имплантацией стентов в коронарное русло.
Положительные результаты рандомизированных исследований сделало стентирования коронарных артерий ведущим стандартом в лечении больных ИБС. С 1999 году под термином чрескожное коронарное вмешательство «по умолчанию» подразумевать именно стентирование коронарных артерий.
Стентирование коронарных артерий или чрескожное коронарное вмешательство – операция, позволяющая восстановить кровоток в артериях сердца (коронарных артериях) путём имплантации стентов в месте сужения коронарной артерии.
Сегодня коронарное стентирование занимает ведущее место в эндоваскулярном лечении больных ИБС. Внедрение этого метода позволило значительно улучшить результаты традиционной ТЛБАП – как непосредственные, так и отдаленные. Основным недостатком стентирования (как и баллонной ангиопластики) является относительно высокая частота рестенозирования. Если применение эндопротезов кардинально решило проблему таких острых осложнений ТЛБАП, как диссекции и острые окклюзии, сведя к минимуму летальность и прочие ишемические осложнения (соответственно, и необходимость выполнения экстренной АКШ), а применение нового режима вспомогательной фармакотерапии (аспирин, клопидогрель, ингибиторы IIb/IIIa-рецепторов), с одной стороны, практически свело к нулю частоту развития подострого тромбоза стентов (и связанных с этим ишемических осложнений), а с другой – позволило имплантировать эндопротезы при остром коронарном синдроме, то в плане отдаленных результатов не произошло революционного сдвига.
Несмотря на то, что отдаленные результаты после стентирования и превосходят результаты ТЛБАП (частота рестенозирования в различных клинических ситуациях в среднем в 1,5–2,5 раза ниже, чем после баллонной дилатации), все же самым серьезным недостатком эндопротезирования (как и всех эндоваскулярных методик) остается относительно высокая частота возврата стенокардии в отдаленном периоде и, соответственно, частая необходимость повторной реваскуляризации миокарда.
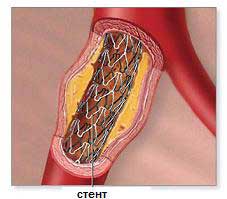
Стент – внутрисосудистый протез для поддержания стенки пораженного сосуда и сохранения диаметра его просвета. Конструкция стента представляет собой тонкий сетчатый каркас из инертного металлического сплава высочайшего качества, раскрываемый баллоном внутри сосуда до нужного диаметра.
Виды стентов:
Металлический стент (Bare Metal Stent) – внутрисосудистый протез из нержавеющей стали или кобальт-хромового сплава. Использование металлических стентов связано с риском тромбоза в первые 30 дней и требует двойной антитромбоцитарной терапии в течении 1 месяца, а также 20-30% риском рестеноза (повторного сужения сосуда) в течение 6-9 месяцев после имплантации.
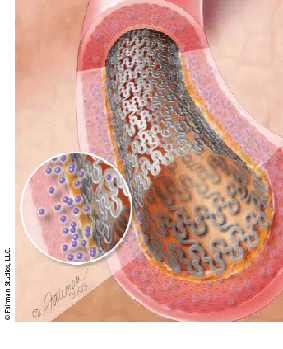
Стент с лекарственным покрытием — внутрисосудистый протез с покрытием (полимером), высвобождающим лекарственное вещество
Первое поколение стентов с лекарственным покрытием: сиролимус- и паклитаксел-покрытые стенты. Множественные рандомизированные исследования показали, что сиролимус- и паклитаксел-покрытые стенты ассоциируются со снижением частоты повторной реваскуляризации и смерти от инфаркта миокарда по сравнению с металлическими стентами. В состав покрытия стентов первого поколения входили полимеры, которые облегчали высвобождение лекарственных компонентов, но оставались на стенте после растворения медикаментозного слоя. Эти постоянные полимеры могут вызывать воспаление и задержку эндотелизации, что требует длительной двойной антиагрегантной терапии с целью предупреждения высокого уровня поздних и очень поздних тромбозов стентов.
За последнее время использование стентов с лекарственным покрытием показало явное их преимущество в борьбе с рестенозом. В клинической практике при использовании стентов без покрытия частота рестеноза в отдаленном периоде оставалась на относительно высоком уровне, начали рассматривать полимерные покрытия как транспортное средство для местной доставки препарата. Целью этого является дозированное выделение необходимого лекарственного средства из устойчивого покрытия в локальную зону поражения сосудистой стенки. Выделение препарата происходит в равномерно дозированной концентрации в определенном временном интервале. Система доставки препарата не теряет своих свойств при стерилизации, так же изменяет свою геометрическую и объемную форму вслед за стентом при его имплантации и устойчива к механическим повреждениям вследствие раздувания баллона. Все вышеизложенные свойства системы локальной доставки препарата осуществляются с помощью разнообразных полимерных структур, обеспечивающих целостность данной структуры при клиническом применении.
Лекарственный препарат должен обладать способностью ингибировать наибольшее количество различных компонентов комплексного процесса рестенозирования. Безудержный рост неоинтимы по некоторым основным характеристикам схож с ростом опухоли, что навело на мысль использования цитостатических препаратов Rapamycin (Sirolimus) и Paclitaxel (Taxol). Результаты превзошли все ожидания.
Второе поколение стентов с лекарственным покрытием: зотаролимус- и эверолимус- покрытые стенты. Стенты изготовлены из более тонкого кобальт-хромового сплава (балки стента – 0,091 мм, по сравнению со стентами первого поколения, где этот показатель составлял – 0,132 мм), демонстрируют превосходную прочность и радиоконтрастность, гибкость что способствует снижению частоты рестеноза. Лекарственный компонент покрытия из более биосовместимых полимеров наносится на всю поверхность стента, примерно 95% от общего количества зотаролимуса высвобождается в течение первых 15 дней после установки стента, эверолимуса – 80% в течение 30дней, последующие 20% за 4 месяца, что позволяет уменьшить воспаление сосудистой стенки. Клинические результаты в сравнении со стентами первого поколения показали эффективность и безопасность.
Стенты третьего поколения – бесполимерные биостенты на основе поли-L лактида или магния созданы с использованием частично и даже полностью биорастворимых полимеров. Биорассасывающиеся магниево-полимерные стенты полностью исчезают после того, как необходимая доза лекарственного компонента высвободилась и лечение сосуда завершено. Высвобождение лекарственных веществ и поддержание стенки сосуда осуществляется только до тех пор, пока сосуду необходимо лечение. Стенты с покрытием, подвергающимся полному биорассасыванию снижают частоту тромбоза стентов по сравнению со стентами без и с лекарственным покрытием.
Возможные перспективы рентгеноэндоваскулярной хирургии ИБС – широкое внедрение в клиническую практику новых генераций стентов с новыми биоабсорбируемыми полимерными покрытиями. Тем не менее их начальному применению должны предшествовать длительные и всеобъемлющие исследования по изучению непосредственных, особенно отдаленных, результатов после их использования.
Таким образом, на сегодняшний день нет альтернативы применению стентов с лекарственным антипролиферативным покрытием в лечении пациентов с ИБС. Широко дискутируемые данные о возможных поздних осложнениях (поздний тромбоз) ни в коей мере не могут являться основанием к прекращению их использования, а лишь дополнительно подчеркивают важность правильного определения показаний к стентированию, тщательного соблюдения всех технических аспектов процедуры имплантации, досконального соблюдения режима двухкомпонентной дезагрегантной терапии в отдаленном периоде.
Непрерывное улучшение конструкции стентов, приводящее к внедрению новых технических методик имплантации, таких как использование высокого давления, методика прямого стентирования (возможного благодаря уменьшению профиля стентов и закреплению его на баллонный катетер доставляющей системы); внедрение таких дополнительных методов визуализации, как интракоронарное ультразвуковое исследование (позволяющих оптимизировать окончательный результат эндопротезирования с высокой степенью точности); тщательный отбор пациентов для проведения процедуры (в зависимости от прогнозируемых непосредственных и отдаленных результатов), основанный на накопленном к настоящему времени колоссальном опыте, – все это позволяет надеяться на улучшение результатов как непосредственно данного метода, так и в целом результатов лечения больных ИБС.
Таким образом, высока вероятность того, что уже в ближайшем будущем изменятся как результаты эндоваскулярного лечения больных ИБС, так и концепция выбора метода реваскуляризации миокарда, подходы к лечению этого заболевания в целом. Применение стентов с лекарственным антипролиферативным покрытием является высокоэффективным методом лечения пациентов с различными клиническими формами ИБС и разными морфологически неблагоприятными вариантами поражения коронарного русла. Применение стентов с антипролиферативным покрытием, несмотря на увеличение объема и комплексности выполняемых вмешательств, позволяет добиться значительного снижения частоты рестенозирования в отдаленном периоде наблюдения – основного фактора, ограничивающего эффективность рентгеноэндоваскулярного лечения.
Чрескожная транслюминальная коронарная ангиопластика (ЧТКА)
Метод чрескожной транслюминальной коронарной ангиопластики (ЧТКА) был открыт еще в 80-е годы 20 века. Данная методика была разработана для удаления суженного участка коронарного сосуда, чтобы обеспечить адекватный кровоток. Обычно, данная операция выполняется больным с острым инфарктом миокарда после проведенной тромболитической терапии, либо в ситуациях, когда она недоступна. Кроме того, ЧТКА проводится больным с ишемической болезнью сердца, когда боли за грудиной нарастают при физической нагрузке, отмечается одышка и другие проявления.
Раньше многие кардиохирурги проводили аортокоронарное шунтирование, теперь врачи используют альтернативный метод – ЧТКА. Перед проведением ангиопластики пациент проходит полное медицинское обследование. В клинике «Центр сердца в Изаре» в Германии проводится тщательное обследование, которое включает выполнение анализов крови, мочи, коагулограммы, а также выполнение ЭКГ, УЗИ сосудов имногие другие процедуры. Все принимаемые препараты обговариваются с лечащим врачом, так как их действие может вызвать нежелательные реакции во время операции.
Особое внимание уделяется противодиабетическим препаратам и средствам, влияющим на свертываемость крови. Операция проводится через бедренную артерию в условиях местной анестезии. Специальную иглу вводят в артерию, после чего катетер с баллончиком заводится до места сужения сосуда. С помощью такого катетера возможно проведение коронароангиографии во время операции, что позволяет сразу оценить состояние сосудов и скорректировать операционную тактику.
После ангиографии кардиохирург увидит места сужений и сможет завести кончик катетера за него. Кроме того, ангиография позволяет оценить, какой тип катетера необходим для операции. В течение всей операции проводится рентгеновский контроль,который позволяет увидеть местоположение катетера. После того как катетер установлен за местом сужения сосуда, врач начинает продвижение баллончика по нему. Баллончик раздувается на месте атеросклеротической бляшки, как бы раздавливая ее. При этом просвет сосуда увеличивается, что способствует нормализации кровотока. Данная операция может быть дополнена стентированием, когда после ангиопластики вводится стент и работает в качестве каркаса в пораженном сосуде.
При таком вмешательстве возможны осложнения в виде аллергических реакций, кровотечений,повреждения структур сердца. Кроме того, возможны нарушения ритма во время процедуры. Однако, в рентген операционной есть все необходимое реанимационное оборудование, которое предназначено для быстрого купирования неотложного состояния.
Благодаря чрескожной транслюминальной коронарной ангиопластике, существенно снижается симптоматика ишемической болезни сердца, боли за грудиной становятся реже, и пациенты себя чувствуют намного лучше. Однако, в будущем возможно повторное нарастание атеросклеротической бляшки, и чтобы этого избежать, необходимо бросить вредные привычки, изменить рацион и увеличить физические нагрузки.
Операцию должен выполнять кардиохирург высокой квалификации с большим опытом её проведения.
Коронарная ангиопластика и стентирование коронарных артерий
(Ангиопластика сердца, стентирование, коронарная ангиопластика, стентирование сосудов сердца)
Правильное название процедуры: Коронарная ангиопластика со стентированием или чрескожное коронарное вмешательство.
Для простоты иногда говорят просто «стентирование».
Что такое стентирование коронарных артерий
Кому показано стентирование сосудов сердца?
Стентирование сосудов сердца показано пациентам с тяжелой стенокардией, после инфаркта миокарда и предынфарктным состоянием, больным с доказанной ишемией (нехваткой крови сердцу) по результатам нагрузочных проб. При этом решение о стентировании принимается только по результатам коронарографии – контрастного исследования сосудов сердца. Коронарография, как и стентирование, выполняется в рентгеноперационной. Часто коронарография «переходит» в стентирование сосудов т.к. выполняется через один и тот же прокол в артерии.
Какие альтернативные стентированию методы существуют?
Как выбрать между стентированием, шунтированием и медикаментозной терапией?
Это задача вашего кардиолога, который учитывает следующие данные:
Методика стентирования коронарных артерий (с профессиональным жаргоном)
Первый инструмент, который попадает к месту сужения артерии – коронарный баллон диаметром чаще всего от 1 до 3.5 мм длиной 10-20 мм. Баллон надевается на проводник и движется по нему до места максимального сужения где он раздувается. Давление внутри баллона при этом достигает 15-20 атмосфер.
Внутрь имплантированного стента заводится жесткий баллон и раздувается большим давлением (до 25 атмосфер). Чаще всего после этого стент расправляется и хорошо прилегает к стенкам артерии.
Контрольная коронарография
Гемостаз
Что делать с отверстием в артерии?
Если вмешательство проводилось через лучевую артерию (на руке) – на запястье надевается специальный браслет с валиком (гемостатическая манжета), который будет давить на место вкола и не допустит кровотечения. В зависимости от ситуации манжета останется на руке от 3 до 12 часов.
В случае бедренного доступа возможны 2 основных варианта:
Коронарная ангиопластика и стентирование
Риск серьезных осложнений очень зависит от степени поражения артерий, локализации бляшек, извитости артерий, наличия кальциноза и, конечно, опыта оператора.
В среднем риск серьезного осложнения не превышает 1%. Этими осложнениями могут быть:
«Малые осложнения» стентирования: