Что такое эмпирическая формула в химии
Эмпирическая формула
Содержание
В экономике
Эмпирические формулы не выводятся математически и не имеют особого смысла в научном понимании. Они только «подгоняют» теоретические значения к эмпирическим, полученным опытным путем. Форму такой зависимости подбирает исследователь. Он же определяет конкретные значения параметров эмпирической формулы.
В химии
В физике
Эмпирической формулой называется математическое уравнение, полученное опытным путём, методом проб и ошибок или как приближённая формула из экспериментальных данных. Таким образом, на момент открытия оно не имеет известного теоретического обоснования. В частности, размерности используемых и вычисляемых в формуле величин не соответствуют друг другу. Другой характерной особенностью таких формул, выражающих эмпирические закономерности, является наличие эмпирических коэффициентов — специально подобранных параметров эмпирической формулы. Эмпирическая формула также может являться простым аналогом более сложного точного теоретического соотношения. В большой степени понятия эмпирическая и феноменологическая формула пересекаются.
Эмпирические формулы широко распространены в прикладных исследованиях, также они появляются в быстро развивающихся отраслях науки, но в этом случае они со временем заменяются точными формулами при накоплении достаточного количества знаний. Одним таким примером является формула Ридберга для длин волн спектральных линий водорода. Предложенная в 1888 году, она прекрасно предсказывала длины волн лаймановской серии, хотя никто не знал, почему она работает, пока Бор в 1913 году не создал свою модель атома водорода.
Ссылки
Примечания
Полезное
Смотреть что такое «Эмпирическая формула» в других словарях:
эмпирическая формула — — [Л.Г.Суменко. Англо русский словарь по информационным технологиям. М.: ГП ЦНИИС, 2003.] Тематики информационные технологии в целом EN cut and try formula … Справочник технического переводчика
эмпирическая формула — empirinė formulė statusas T sritis chemija apibrėžtis Formulė, rodanti junginio elementų paprasčiausią kiekybinį santykį. atitikmenys: angl. empirical formula rus. эмпирическая формула … Chemijos terminų aiškinamasis žodynas
эмпирическая формула — empirinė formulė statusas T sritis fizika atitikmenys: angl. empirical formula vok. empirische Formel, f rus. эмпирическая формула, f pranc. formule empirique, f … Fizikos terminų žodynas
Формула Ридберга — в том виде, в котором она была представлена в ноябре 1888 года Формула Ридберга эмпирическая формула, описывающая длины волн в спектрах излучения атомов химических элементов. Предложена шведским учёным Йоханнесом Ридбергом и предста … Википедия
Формула Дарси — Формула Вейсбаха[1] в гидравлике эмпирическая формула, определяющая потери напора или потери давления при развитом турбулентном течении несжимаемой жидкости на гидравлических сопротивлениях (предложена Юлиусом Вейсбахом (англ.) в 1855… … Википедия
Формула Прони — Формула Прони это исторически важная формула в гидравлике, применявшаяся для расчётов потерь напора на трение при течении жидкости по трубам. Это эмпирическая формула, полученная французом Гаспаром де Прони в XIX веке: где hf потери… … Википедия
Формула Хазена — Вильямса эмпирическая формула, устанавливающая связь свойств потока воды в трубопроводе с физическими свойствами трубы и падением давления вследствие трения. Формула используется при конструировании водопроводных систем[1], таких как… … Википедия
Формула перемен — Формула перемен эмпирическая формула, описывающая модель для оценки сил, влияющих на успех или неудачу программы организационных изменений. Была разработана Ричардом Бекхардом и Дейвидом Глейтчером и иногда называется Формулой Глейчера. D x … Википедия
ФОРМУЛА — (1) символическая запись, состоящая из цифр, букв и специальных знаков, расположенных в определённом порядке, и являющаяся точным определением какого либо закона, отношения, процесса, явления и т. п., которое приложимо в определённых условиях ко… … Большая политехническая энциклопедия
Формула Борда — В гидродинамике, формула (теорема) Борда Карно это эмпирическая формула, описывающая потери энергии (или напора) жидкости, происходящие при местном расширении потока. Эта формула, в отличие от уравнения Бернулли для идеальной жидкости … Википедия
Урок 12. Элементный анализ
В уроке 12 «Элементный анализ» из курса «Химия для чайников» рассмотрим анализ химического состава вещества; научимся определять эмпирическую формулу соединения; кроме того разберем кучу примеров на нахождение весовых процентов и формулы вещества. Данный урок потребует от вас знания, что из себя представляет молекулярная формула соединения, а так же общих сведений, изложенных в первой главе «Атомы, молекулы и ионы». Обязательно прочитайте о законе сохранения массы и энергии, потому что все уроки из данного раздела посвящены именно ему.
Анализ химического состава вещества
Пример 1: При сжигании неизвестного углеводорода массой 25 г образуется 68,58 г CO2 и 56,15 г H2O. Сколько граммов углерода и водорода содержится в исходном образце?
Атомная масса C равна 12,011 г/моль, а молекулярная масса CO2 равна 12,011 + 2×15,999 = 44,010 г/моль. Сначала найдем относительное содержание C в CO2:
Если 27,29% CO2 представляют собой углерод, то количество углерода, содержащееся в 68,58 г CO2, равно
Аналогичный расчет содержания H в воде дает
Проверка: 18,72 г + 6,283 г = 25,00 г
Пример 2: Сколько граммов C содержится в 100 г образца углеводорода, рассмотренного в примере 1?
Пример 3: Каков состав (в весовых процентах) углеводорода, рассматриваемого в примере 1?
Если нам известен состав вещества в весовых процентах, можно воспользоваться атомными массами входящих в него элементов и вычислить относительное число атомов каждого элемента в соединении.
Пример 4: Вычислите относительное число атомов C и H в соединении, рассматриваемом в примере 3.
Такие вычисления легче проводить, исходя из 100,0 г вещества: тогда весовые проценты, в которых выражен элементный состав соединения, можно просто заменить на такое же число граммов соответствующих элементов (ср. примеры 3 и 2). Теперь разделим массу C и массу H на их атомные массы:
Таковы относительные количества молей C и H в неизвестном углеводороде, и вот тут-то мы убедимся, насколько удобно пользоваться представлением о моле. Полученные выше численные значения должны также выражать относительные количества атомов углерода и водорода в соединении, то есть на каждые 6,234 атома углерода в неизвестном углеводороде приходится 24,92 атома водорода. Если мы попытаемся найти общее кратное этих двух чисел, то окажется, что они находятся в соотношении 1:4. Разделив оба числа на меньшее из них (16,234), мы найдем, на каждый атом углерода приходится 24,92/6,234=3,997, т.е 4 атома водорода.
Пример 5: Жидкость содержит 11,19 вес.% водорода и 88,81 вес.% кислорода. Каковы относительные количества атомов водорода и кислорода в этой жидкости?
Рассмотрим снова 100 г вещества и вычислим количество молей каждого элемента, входящего в его состав:
Разделим оба числа на меньшее из них, чтобы найти общее кратное и тогда мы получим, что на каждый атом кислорода приходится по два атома водорода.
Пример 6 решаем самостоятельно: Обычный лабораторный растворитель, углеводород, содержит 92,26 вес.% углерода и 7,74 вес.% водорода. Каковы относительные количества атомов углерода и водорода в этом соединении?
Ответ: на 1 атом углерода приходится по 1 атому водорода
Эмпирическая формула вещества
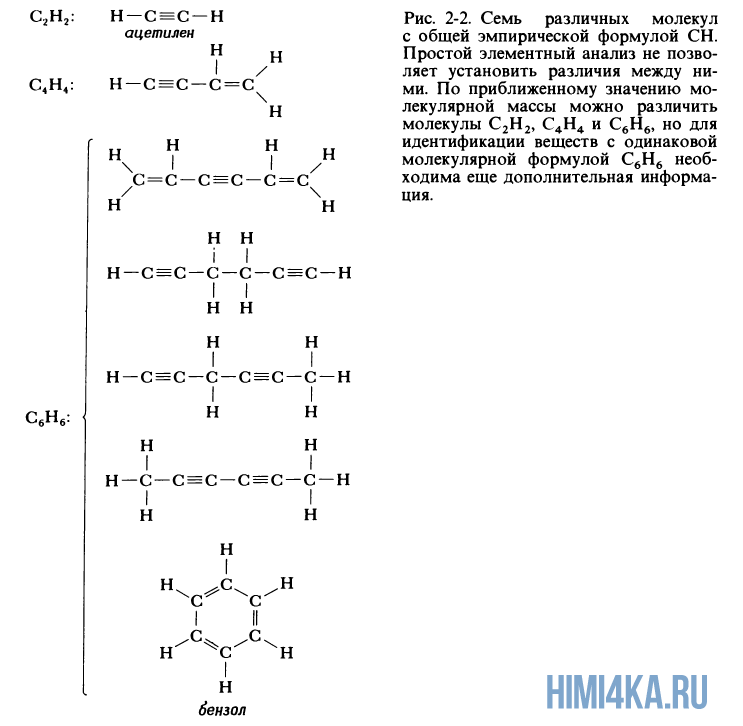
Химическая формула, указывающая относительные количества атомов каждого из элементов в соединении при помощи целых чисел, не имеющих общего кратного, называется эмпирической формулой соединения. Элементный анализ вещества приводит именно к эмпирической формуле соединения, а не к молекулярной формуле, которая может совпадать с эмпирической формулой, но может представлять собой ее целое кратное. Для метана и воды эмпирические формулы совпадают с молекулярными формулами CH4 и H2O. Например вещество из примера 6 имеет эмпирическую формулу CH, но молекулярная формула может представлять собой бензол С6H6, ацетилен C2H2 или любой из пяти других, менее распространенных углеводородов, молекулы которых изображены на рисунке 2-2.
Определение формулы вещества
Закрепим полученные знания заключительным примером:
Глюкоза содержит 40,00 вес.% углерода, 6,71 вес.% водорода и 53,29 вес.% кислорода. Каковы ее эмпирическая и молекулярная формулы, если из других экспериментов известно, что глюкоза имеет молекулярную массу, приблизительно равную 175 г/моль?
Найдем сначала число молей каждого элемента, приходящихся на 100 г глюкозы:
Очевидно, что эмпирическая формула вещества должна иметь вид CH2O. Найденной эмпирической формуле глюкозы соответствует молекулярная масса
Приближенная молекулярная масса из экспериментов почти в 6 раз превышает это значение, поэтому можно сделать вывод, что молекулярная формула глюкозы имеет вид C6H12O6.
Урока 12 «Элементный анализ» очень важный, поэтому если у вас возникли вопросы, пишите их в комментарии.
Разница между эмпирической и молекулярной формулой
Ключевая разница: Эмпирическая формула химического соединения показывает простейшее положительное целочисленное соотношение атомов каждого элемента, присутствующего в соединении. Молекулярная формула
Содержание:
Формулы играют важную роль в химии и физике. Хотя элемент или молекула могут быть названы его общим названием, они не дают много информации об указанном элементе или молекуле. Следовательно, формулы используются. В зависимости от типа формулы, он может предоставить определенную информацию о молекуле, которую человек должен будет отослать обратно в периодическую таблицу. Есть два типа формул, которые обычно используются: эмпирические и молекулярные.
Эмпирическая формула химического соединения показывает простейшее положительное целочисленное соотношение атомов каждого элемента, присутствующего в соединении. Это не относится к изомерии, структуре или абсолютному числу атомов соединения. Это также не обеспечивает реальное количество атомов в соединении. Например, глюкоза имеет молекулярную формулу С6ЧАС1206поэтому его эмпирическая формула будет CH2О. Показывает соотношение между атомами каждого элемента в соединении. Так что для вечного атома углерода и кислорода требуются два атома водорода. Эмпирическая формула используется в качестве стандарта для большинства ионных соединений и для макромолекул. Международный союз теоретической и прикладной химии (IUPAC) определяет «эмпирическую формулу» как «сформированную путем сопоставления атомных символов с их соответствующими индексами, чтобы дать простейшую возможную формулу, выражающую состав соединения». Два разных соединения могут разделять эмпирические формула. Например, молекулярная формула бутана является C4ЧАС8, что делает его эмпирической формулой СН2в то время как молекулярная формула этилена является C2ЧАС4, что делает его эмпирическую формулу такой же, как CH2, Однако это два разных соединения. Эмпирическая формула обычно используется для определения молекулярной формулы соединения.
Молекулярная формула соединения, также известная как химическая формула, представляет собой способ выражения количества атомов, которое каждый элемент имеет в этом конкретном соединении. Например, молекулярная формула этанола представляет собой СН3СН2ОН, что означает, что он имеет 6 атомов водорода, два атома углерода и один атом кислорода. Расположение и связь атомов составляют соединение. Если соединения были связаны по-разному, это сделало бы совершенно другое соединение. Химическая формула обычно выражается с помощью одной строки символов химического элемента, чисел и может также включать другие символы, такие как скобки, тире, скобки, а также знаки плюс (+) и минус (-). Молекулярная формула обеспечивает правильную структуру соединения. Тем не менее, он отличается от структурной формулы, которая показывает, как связи между атомами связаны. Молекулярная формула обычно используется в химической реакции для отображения химических деталей или изменений. Молекулярная масса также полезна для расчета молекулярной массы элемента в соединении. Кроме того, он также может помочь предсказать количество ионов в соединении и сколько из них будет высвобождаться при растворении в воде в ионном соединении. Молекулярная формула не может быть использована для определения точного молекулярного расположения соединения. Это потому, что одно соединение может быть использовано для создания нескольких структурных формул, известных как изомеры. Изомеры представляют собой соединения, которые имеют одинаковую молекулярную формулу, но другую структурную формулу. Молекулярная формула также может помочь выявить все возможные изомеры для молекулы.
Обе эти формулы часто используются в химии и физике в зависимости от потребностей человека.
Разница между эмпирическими и молекулярными формулами
В ключевое отличие между эмпирическими и молекулярными формулами заключается в том, что эмпирическая формула дает только простейшее соотношение атомов, тогда как молекулярная формула дает точное колич
Содержание:
В ключевое отличие между эмпирическими и молекулярными формулами заключается в том, что эмпирическая формула дает только простейшее соотношение атомов, тогда как молекулярная формула дает точное количество каждого атома в молекуле.
Что такое эмпирические формулы?
Видео 01: Эмпирическая формула
Далее, Ca3(PO4)2 также является эмпирической формулой. В ионном соединении мы можем легко написать формулу, поменяв местами заряды каждого иона, и это автоматически даст номер каждого иона в молекуле. Также мы можем написать эмпирические формулы для макромолекул. При написании эмпирических формул для полимеров мы пишем повторяющуюся единицу, а затем используем букву «n», чтобы сказать, что в полимере может быть n повторяющихся единиц. Однако мы не можем использовать эмпирическую формулу для определения массы, структуры или изомеров молекулы, но она полезна для аналитических целей.
Что такое молекулярные формулы?
Обычно мы используем молекулярную формулу в химических реакциях или при документировании любых химических деталей. Просто взглянув на молекулярную формулу, мы можем получить много информации о молекуле. Например, мы можем рассчитать молекулярную массу. Кроме того, если это ионное соединение, мы можем предсказать, что это за ионы и сколько их будет высвобождаться при растворении в воде.
Видео 02: Сравнение молекулярных и эмпирических формул
Кроме того, мы можем предсказать степень окисления каждого атома, то, как они будут реагировать в реакции, и полученные продукты, используя молекулярные формулы. Однако, исходя только из молекулярной формулы, мы не можем предсказать точное расположение молекул. Потому что иногда для одной молекулярной формулы существует несколько структурных формул. Это «изомеры». Изомеры имеют одинаковую молекулярную формулу, но могут отличаться от связности атомов (структурные изомеры) или пространственного расположения атомов (стереоизомеры). Итак, глядя на молекулярную формулу, мы можем записать все возможные изомеры для молекулы.
В чем разница между эмпирическими и молекулярными формулами?
Для определенной молекулы или макромолекулы мы можем написать эмпирическую формулу. Однако молекулярная формула является более подробной формой. Ключевое различие между эмпирическими и молекулярными формулами состоит в том, что эмпирическая формула дает только простейшее соотношение атомов, тогда как молекулярная формула дает точное количество каждого атома в молекуле.
Эмпирическая формула
Эмпирические формулы не выводятся математически и не имеют особого смысла в научном понимании. Они только «подгоняют» теоретические значения к эмпирическим, полученным опытным путем. Форму такой зависимости подбирает исследователь. Он же определяет конкретные значения параметров эмпирической формулы.
Эмпирической формулой называется математическое уравнение полученное опытным путём методом проб и ошибок или как приближённая формула из экспериментальных данных. Таким образом, она на момент открытия не имеет известного теоретического обоснования. В частности, размерности используемых и вычисляемых в формуле величин не соответствуют друг другу. Другой характерной особенностью таких формул, выражающих эмпирические закономерности, является наличие эмпирических коэффициентов — специально подобранных параметров эмпирической формулы. Эмпирическая формула также может являться простым аналогом более сложного точного теоретического соотношения.
Эмпирические формулы широко распространены в прикладных исследованиях, также они появляются в быстро развивающихся отраслях науки, но в этом случае они со временем заменяются точными формулами при накоплении достаточного количества знаний. Одним таким примером является формула Ридберга предсказывающая длины волн спектральных линий водорода. Предложенная в 1888 году она прекрасно предсказывала длины волн лаймановской серии, хотя никто не знал почему она работает, пока Бор не предложил свою модель атома водорода в 1913 году.