Что такое этиленгликоль в химии
Этиленгликоль
| Этиленгликоль | |
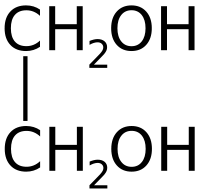 | |
 | |
| Общие | |
|---|---|
| Систематическое наименование | этан диол-1,2 |
| Традиционные названия | этиленгликоль, 1,2-диоксиэтан, 1,2-этандиол |
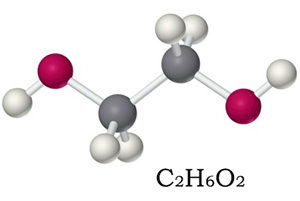
| Химическая формула | C2H4(OH)2 |
| Физические свойства | |
| Состояние (ст. усл.) | жидкость |
| Молярная масса | 62,068 г/моль |
| Термические свойства | |
| Температура плавления | −12,9 °C |
| Температура кипения | 197,3 °C |
| Классификация | |
| Рег. номер CAS | 107-21-1 |
| SMILES | OCCO |
| Безопасность | |
| Токсичность | токсичен |
Содержание
История открытий и производства
Этиленгликоль впервые был получен в 1859 французским химиком Вюрцом из диацетата этиленгликоля омылением гидроксидом калия и в 1860 гидратацией этиленоксида. Он не находил широкого применения до Первой мировой войны, когда в Германии его стали получать из дихлорэтана для использования в качестве замены глицерина при производстве взрывчатых веществ. В США полупромышленное производство начато в 1917 году через этиленхлоргидрин. Первое крупномасштабное производство начато с возведением завода в 1925 году около Южного Чарлстона (западная Вирджиния, США) компанией «Carbide and Carbon Chemicals Co.» К 1929 году этиленгликоль использовался практически всеми производителями динамита. В 1937 кампания Carbide начало первое крупномасштабное производство, основанное на газофазном окислении этилена до этиленоксида. Монополия компании Carbide на данный процесс продолжалась до 1953 года.
Получение
В промышленности этиленгликоль получают путём гидратации оксида этилена при 10 атм и 190—200°С или при 1 атм и 50—100°С в присутствии 0,1—0,5 % серной или ортофосфорной кислоты, достигая 90% выхода. Побочными продуктами при этом являются этиленгликоль, триэтиленгликоль и незначительное количество высших полимергомологов этиленгликоля.
Применение
Благодаря своей дешевизне этиленгликоль нашёл широкое применение в технике.
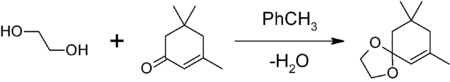
1,3-диоксоланы могут быть получены также при реакции этиленгликоля с карбонильными соединениями в присутствии триметилхлорсилана [2] или комплекса диметилсульфат-ДМФА [3] 1,3-диоксалана устойчивы к действию нуклеофилов и оснований. Легко регенерируют исходное карбонильное соединение в присутствии кислоты и воды.
Этиленгликоль также применяется:
Очистка и осушение
Осушается молекулярным ситом 4А, полуводным сульфатом кальция, сульфатом натрия, Mg+I2, фракционной перегонкой под пониженным давлением, азеотропной отгонкой с бензолом. Чистота полученного продукта легко определяется по плотности.
Таблица плотности водных растворов этиленгликоля, 20°С
| Концентрация % | 30 | 35 | 40 | 45 | 50 | 55 | 60 |
|---|---|---|---|---|---|---|---|
| Плотность, г/мл | 1,050 | 1,058 | 1,067 | 1,074 | 1,082 | 1,090 | 1,098 |
Меры безопасности
Этиленгликоль: химические свойства и получение
Этиленгликоль C2H4(OH)2 или CH2(OH)CH2OH, этандиол-1,2 – это органическое вещество, предельный двухатомный спирт .
Общая формула предельных нециклических двухатомных спиртов: CnH2n+2O2 или CnH2n(OН)2
Строение этиленгликоля
В молекулах спиртов, помимо связей С–С и С–Н, присутствуют ковалентные полярные химические связи О–Н и С–О.
| Электроотрицательность кислорода (ЭО = 3,5) больше электроотрицательности водорода (ЭО = 2,1) и углерода (ЭО = 2,4). |
Электронная плотность обеих связей смещена к более электроотрицательному атому кислорода:
Водородные связи и физические свойства спиртов
Спирты образуют межмолекулярные водородные связи. Водородные связи вызывают притяжение и ассоциацию молекул спиртов:
Поэтому этиленгликоль – жидкость с относительно высокой температурой кипения.
Водородные связи образуются не только между молекулами спиртов, но и между молекулами спиртов и воды. Поэтому спирты очень хорошо растворимы в воде. Молекулы спиртов в воде гидратируются:
| Чем больше углеводородный радикал, тем меньше растворимость спирта в воде. Чем больше ОН-групп в спирте, тем больше растворимость в воде. |
Химические свойства этиленгликоля
Спирты – органические вещества, молекулы которых содержат, помимо углеводородной цепи, одну или несколько гидроксильных групп ОН.
1. Кислотные свойства
| Спирты – неэлектролиты, в водном растворе не диссоциируют на ионы; кислотные свойства у них выражены слабее, чем у воды. |
1.1. Взаимодействие с раствором щелочей
При взаимодействии этиленгликоля с растворами щелочей реакция практически не идет, т. к. образующийся алкоголят почти полностью гидролизуется водой.
Равновесие в этой реакции так сильно сдвинуто влево, что прямая реакция не идет. Поэтому этиленгликоль не взаимодействует с растворами щелочей.
1.2. Взаимодействие с металлами (щелочными и щелочноземельными)
Этиленгликоль взаимодействует с активными металлами (щелочными и щелочноземельными).
Алкоголяты под действием воды полностью гидролизуются с выделением спирта и гидроксида металла.
2. Реакции замещения группы ОН
2.1. Взаимодействие с галогеноводородами
При взаимодействии этиленгликоля с галогеноводородами группы ОН замещаются на галоген и образуются дигалогеналкан.
| Например, этиленгликоль реагирует с бромоводородом. |
2.2. Этерификация (образование сложных эфиров)
Многоатомные спирты вступают в реакции с карбоновыми кислотами, образуя сложные эфиры.
| Например, этиленгликоль реагирует с уксусной кислотой с образованием эфира: |
2.4. Взаимодействие с кислотами-гидроксидами
Этиленгликоль взаимодействует и с неорганическими кислотами, например, азотной или серной.
| Например, при взаимодействии этиленгликоля с азотной кислотой образуется нитроэтиленгликоль : |
3. Дегидратация
В присутствии концентрированной серной кислоты от спиртов отщепляется вода. При высокой температуре (180 о С) протекает внутримолекулярная дегидратация этиленгликоля и образуется соответствующий ацетальдегид.
4. Окисление этиленгликоля
Реакции окисления в органической химии сопровождаются увеличением числа атомов кислорода (или числа связей с атомами кислорода) в молекуле и/или уменьшением числа атомов водорода (или числа связей с атомами водорода).
Типичные окислители — оксид меди (II), перманганат калия KMnO4, K2Cr2O7, кислород в присутствии катализатора.
4.1. Окисление оксидом меди (II)
Этиленгликоль можно окислить оксидом меди (II) при нагревании. При этом медь восстанавливается до простого вещества.
4.2. Окисление кислородом в присутствии катализатора
Этиленгликоль можно окислить кислородом в присутствии катализатора (медь, оксид хрома (III) и др.).
4.3. Жесткое окисление
При жестком окислении под действием перманганатов или соединений хрома (VI) этиленгликоль окисляется до щавелевой кислоты.
| Например, при взаимодействии этиленгликоля с перманганатом калия в серной кислоте образуется щавелевая кислота |
4.4. Горение этиленгликоля
При сгорании этиленгликоля образуется углекислый газ и вода и выделяется большое количество теплоты.
5. Дегидрирование этаниленгликоля
При нагревании спиртов в присутствии медного катализатора протекает реакция дегидрирования.
| Например, при дегидрировании этиленгликоля образуется этандиаль |
Получение этиленгликоля
1. Щелочной гидролиз дигалогеналканов
При взаимодействии дигалогеналканов с водным раствором щелочей образуются двухатомные спирты. Атомы галогенов в дигалогеналканах замещаются на гидроксогруппы.
| Например, при нагревании 1,2-дихлорэтана с водным раствором гидроксида натрия образуется этиленгликоль |
2. Гидрирование карбонильных соединений
| Например, при гидрировании этандиаля образуется этиленгликоль |
О=CН-CH=O + 2H2 → CH2(OH)-CH2OH
3. Гидролиз сложных эфиров
При гидролизе сложных эфиров этиленгликоля и карбоновых кислот образуются этиленгликоль и карбоновая кислота.
4. Мягкое окисление алкенов
Мягкое окисление протекает при низкой температуре в присутствии перманганата калия. При этом раствор перманганата обесцвечивается.
В молекуле алкена разрывается только π-связь и окисляется каждый атом углерода при двойной связи.
При этом образуются двухатомные спирты (диолы).
Отравление этиленгликолем

Что такое этиленгликоль, какая у него формула и физические свойства? Как его получают и где применяют? Чем опасен для организма человека этот спирт? В каких случаях происходит отравление им и что за симптомы беспокоят при этом? Как нужно действовать, чтобы помочь пострадавшему?
Что такое этиленгликоль
Этиленгликоль — это представитель спиртов с двумя метильными группами в своём составе. Но в отличие от других он имеет немного маслянистую консистенцию.
Несмотря на то что этиленгликоль был получен ещё в 1859 году, он не сразу занял свою нишу в химии и промышленности. Изначально он использовался во времена Первой мировой войны, как замена глицерина, который широко применялся при производстве взрывчатых веществ.
Химическая формула этиленгликоля — C2H6O2, рациональная — С2Н4(ОН)2. По своим физическим свойствам — это жидкость без запаха, но со сладким вкусом. Он легко соединяется с водой в любой консистенции, что успешно применяется в промышленности, ведь температура замерзания таких жидкостей очень низкая — это улучшает свойства «незамерзаек».
Чаще других употребляется основное название.
К какому классу опасности относится этиленгликоль? — к умеренно токсичное легковоспламеняющееся вещество.
Способы получения
Производством этиленгликоля в промышленных масштабах занялись ещё в тридцатые годы прошлого века. Одним из способов его получения тогда было окисление этилена до его оксида. Около 20 лет такой метод оставался единственным.
Немного позже этиленгликоль стали получать с помощью насыщения оксида этилена водой, в присутствии серной и ортофосфорной кислот. Этот способ оказался выгодней предыдущего, так как на выходе производили более 90% этиленгликоля с минимальным количеством примесей.
Где применяется
В основном этиленгликоль используют в промышленности для обработки техники, что обусловлено его стоимостью — это недорогой и всем доступный продукт.

Где ещё используется этиленгликоль?
За прошедшие десятилетия для этого двухатомного спирта нашлось множество применений, что, конечно же, обусловлено его свойствами. Но в медицине он известен не только как полезный и нужный продукт в быту, но и как средство, после контакта с которым человек может умереть.
Влияние этиленгликоля на организм человека
Этот двухатомный спирт в основном входит в состав продуктов для ухода за помещениями, машинами и техникой. По своим физическим свойствам он отличается от привычного спирта маслянистой консистенцией и отсутствием запаха, поэтому его сложно перепутать с этанолом или изопропанолом, которые нередко употребляют внутрь. Возможны ли отравления этиленгликолем у людей? — да, несмотря на явные различия с другими спиртами отравиться им можно.
В каких случаях происходит отравление?
Этиленгликоль токсичен и относится к веществам третьего класса опасности. После поступления в организм человека он очень быстро всасывается в желудке и верхнем отделе тонкого кишечника. Не более 30% его выделяется в неизменном состоянии почками или в виде солей. Остальная же часть поступает в печень, где и происходит его преобразование.
В печени он разлагается до конечных продуктов:
Как влияет этиленгликоль на организм человека? Все эти конечные продукты распада действуют на кислотно-щелочное равновесие, что постепенно приводит к некрозу клеток головного мозга и почечной ткани. В организме развивается ацидоз или увеличение кислотности. Смертельная доза для человека составляет всего 100–150 мл. Но даже попадание небольшого количества этиленгликоля приведёт к развитию отравления, хотя и в лёгкой степени.
Симптомы отравления
В воспалительный процесс после употребления этиленгликоля вовлекаются не только почки и головной мозг. Спирт и его конечные продукты влияют на все системы органов. Скрытый период отравления этиленгликолем в среднем равен 12 часов, но он может укорачиваться или удлиняться в зависимости от количества употреблённого спирта.

Лёгкое отравление этиленгликолем наблюдается чаще при вдыхании его паров небольшой концентрации. Оно проявляется незначительными симптомами: слабостью, подташниванием, головокружением.
Первая помощь при отравлении
К сожалению, часто причиной запоздалой или несвоевременной помощи становится лёгкое течение отравления, хроническая интоксикация парами этого спирта или позднее обращение пострадавшего человека к медработникам. В этом случае продукты распада гликоля уже оказывают своё повреждающее действие на внутренние органы и наносят непоправимый ущерб здоровью.
Что можно сделать на доврачебном этапе, чтобы помочь пострадавшему? Для этого необходимо быть уверенным в употреблении именно этого вещества. Если этиленгликоль был выпит недавно — нужно незамедлительно промыть желудок и ввести слабительное. Активированный уголь не окажет выраженного эффекта.
Быстро помочь при отравлении этиленгликолем, может, антидот — этанол. В этом случае применяется во внутрь его 30%-й раствор или 5%-й вводится внутривенно. А также в качестве антидота используется кальция хлорид или глюконат 10%-й раствор внутривенно или внутрь.
Не у всех под рукой могут оказаться нужные лекарства для оказания экстренных мероприятий. В этом случае неотложная помощь при отравлении этиленгликолем заключается во введении через зонд или рот обычной водки.
Если человек без сознания — его нужно уложить набок и дать доступ кислорода — открыть окно, развязать галстук и освободить от стягивающей одежды.
До момента начала активных действий нужно вызвать бригаду скорой помощи, так как пострадавшему понадобится госпитализация.
При отравлении этиленгликолем у детей нужно действовать незамедлительно и как можно скорее доставить пострадавшего малыша в ближайшую больницу!
Лечение отравления в стационаре
После госпитализации больному человеку проводят курс интенсивной терапии. Если пострадавшему не был дан антидот бригадой скорой помощи, то по прибытии в стационар его вводят сразу же.
Дальше лечение заключается в применении симптоматических препаратов для коррекции работы жизненно важных органов и систем.
Профилактика отравления
Какая должна быть профилактика отравления этиленгликолем?
Что такое кодирование от алкогольное зависимости
Многие люди, злоупотребляющие алкоголем, решают избавиться от зависимости с помощью кодирования. Цель данной методики — реализовать отношение пациента к чувству отвращения к алкогольным напиткам. Современная медицина предлагает несколько методов кодирования, которые можно разделить на лечебные и снотворные. Узнать подробнее про центр лазерной медицины «Луч» можно перейдя по ссылке.
Ведущие психотерапевты относят методы кодирования от алкоголя к эмоционально-стрессорному психологическому лечению, поскольку такой терапии достаточно. Из тяжелых побочных эффекты: повышенная раздражительность, конфликтность, агрессия, поиск ошибок и мелочность. Многие люди после программирования становятся вялыми и психологически подавленными. У них снизилось либидо и повысилось беспокойство. Наиболее уязвимы пациенты, деятельность которых связана с высоким уровнем ответственности и повышенным нервным напряжением. В большинстве случаев кодирование от алкоголя вызывает дополнительный стресс, в результате чего развивается тяжелая депрессия и, как следствие, последующее прерывание человека с уходом в более глобальную пьянку.
Алкогольное кодирование следует рассматривать как начальный этап лечения, параллельно с которым необходимо проводить огромную психологическую и психотерапевтическую работу, чтобы помочь пациенту самостоятельно преодолеть зависимость и улучшить качество своей жизни, а также научить его смотреть на мир с положительной точки зрения. Для достижения максимальной эффективности от лечения алкоголизма в первую очередь следует устранить основные причины, приведшие к этому состоянию, и только потом приступать к устранению последствий.
Наиболее распространенные способы борьбы с алкоголизмом:
Последний метод особенно подходит для пациентов, которые хорошо реагируют на внушение снотворным. Как правило, после проведения такой процедуры с помощью психотерапевта и нарколога проводится общераспространенное очищение зависимого организма.
Понятие и свойства
Этиленгликоль (МЭГ, моноэтиленгликоль) – химический реактив, который 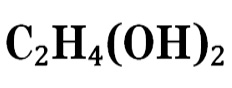
К списку свойств этиленгликоля можно отнести и свойства гликолей. Так, с такими химреактивами, как органические кислоты, образует сложные эфиры, щелочи и щелочные металлы – гликоляты. При окислении этиленгликоля возможно образование смесей гликолевого альдегида и щавелевой кислоты купить которую по доступной цене предлагает наш интернет магазин, а при окислении молекулярным кислородом – смесь муравьиной кислоты.
Данное химическое соединение выпускается двух марок: антифризный и волоконный, к последнему предъявляют очень серьезные требования к количественному содержанию примесей альдегидов.
Открытие этиленгликоля
Данный химический реактив впервые был получен химиком Вюрцом во Франции в середине XIX века. До начала Первой мировой войны он не имел широкого применения, позже в Германии во время военных действий его стали использовать как заменитель глицерина в процессе производства взрывчатых веществ. К 1930 году этиленгликоль стал активно использоваться многими известными производителями динамита.
Токсические и ядовитые действия этиленгликоля зависят от ряда факторов, среди которых следует выделить:
— количество;
— индивидуальную чувствительность организма;
— состояние нервной системы;
— степень наполнения желудка и другие.
Дозы, которые могут привести в организме к необратимым изменениям и вызвать смертельное отравление этиленгликолем, могут варьироваться от 100 до 700 мл. По данным ряда исследований для человека летальной дозой является 50-200 мл. При поражении этиленгликолем смертность очень высока и составляет примерно 60 % всех случаев отравления.
Применение
Области применения данного химического реактива весьма разнообразны. 
— в машиностроительной (в производстве тосола, тормозных жидкостях, антифриза);
— в текстильной (как растворитель красящих веществ);
— энергетической (как теплоноситель в отопительных системах);
— в химической (при производстве полимеров: целлофана, полиуретана, при синтезе высокотемпературных растворителей, для предотвращения процесса образования гидрата метана);
— электротехнической (в качестве вещества, защищающее объекты от замораживания, при производстве конденсаторов, как составляющий компонент в системе жидкостного охлаждения компьютеров);
— в военной (как исходное сырьё при производстве нитрогликоля – взрывоопасного вещества).
Меры безопасности, хранение
Хранить этиленгликоль необходимо в лабораторной посуде из стали, стойкой к коррозии, в закрытых неотапливаемых помещениях.
В связи с тем, что этиленгликоль ядовит, важно не допускать его попадания внутрь организма, так как это токсичное вещество влечет за собой необратимые изменения в работе внутренних органов и может привести к летальному исходу.
Этиленгликоль в соответствии с классификацией химвеществ причислен к третьему классу опасности: он взрывоопасен и горюч, поэтому при работе с ним следует придерживаться особых мер безопасности, используя защитные средства для органов дыхания – противогазы, респираторы, маски; для органов зрения – защитные очки; для кожных покровов – перчатки нитроловые, фартук, бахилы и другие резинотехнические изделия. Лабораторное оборудование и приборы должны быть использованы согласно требованиям инструкции по безопасности при работе с ядовитыми веществами.
Необходимо знать, что в случае отравления МЭГ первая доврачебная помощь должна быть проведена в срочном порядке. Это, прежде всего, промывание желудка плюс слабительные, вызывание рвоты, врачебная – назначение антидота.
Качественные химические реактивы по доступной цене
К выбору приобретения химических реактивов, а также любого другого лабораторного оборудования в Москве следует отнестись с особой ответственностью, так как от качества данной продукции зависят и результаты исследовательских процессов. Как кальций хлористый купить или молочную кислоту купить, так и этиленгликоль стоит в специализированных магазинах, где соблюдаются требования по хранению и отпуску товаров. Одним из таких является магазин химических реактивов Москва розница и оптовая торговля Prime Chemicals Group. Мы специализируемся только по продаже только сертифицированного лабораторного оборудования и химвеществ.
«ПраймКемикалсГрупп» – надежный помощник в оснащении Вашей лаборатории!