Энтропия это простыми словами в психологии что такое
Психическая энтропия. Состояние ума.
Психическая энтропия. Состояние ума.
Психическая энтропия – это беспорядок сознания, когда наше внутреннее внимание, сосредоточенное на какой-то цели, перемешивается с разными мыслями, которые отвлекают нас от нашей цели.
В термодинамике же энтропия определяет меру необратимого рассеяния энергии.
Что происходит у человека: возникает хаос в голове, особенно, когда человек живет и работает в режиме многозадачности. Человек постоянно реагирует на вызовы со стороны, отвлекаясь от своих целей, тем самым, не достигая их своевременно, либо вовсе откладывая задачи на потом. Тогда возникает состояние, когда «проблемы» наваливаются одна на другую. Человек начинает «срываться» на окружающих через неконтролируемые негативные эмоции и поведение и т.д. по нисходящей.
Таким образом, в процессе беспорядка наших мыслей у человека возникает стрессовое состояние, сопровождающееся потерей энергии.
Как избавиться от психической энтропии?
Пожалуй, никак! Возможно только снизить ее до минимума, насколько это возможно.
Способы:
Планируя вы формируете структуру своих мыслей, уменьшая хаос в голове.
2. Концентрация на Важных делах в жизни.
Сделайте анализ своих жизненных целей и оцените насколько текущие дела приближают вас к ним. По максимуму включайте в планы Важные дела. Это позволит быть осознанным в жизни.
3. Ограничение кол-ва целей на период времени.
Не перегружайте себя, выбирайте комфортный для Вас режим достижения своих целей, который позволит иметь время и на «новые срочные вводные», которые нам подкидывают жизненные ситуации.
Старайтесь не позволять неважным делам и мыслям завладеть вашим сознанием.
5. Доверьтесь жизненному процессу.
Если вашим целям и намерениям что-то мешает свершиться, не сопротивляйтесь, возможно, Сверху виднее, что вам лучше и когда этому быть.
6. Состояние потока.
Концентрируйтесь на деталях процесса, не отвлекайтесь, осознавайте себя в текущем моменте. Старайтесь выполнить задачу качественно. Вы получите чувство удовлетворенности от состояния здесь и сейчас, которое, к тому же, сильно вас успокоит.
Как только возникает свободная минутка, используйте ее для релаксации: расслабьте скальп; сделайте самомассаж; либо сходите на массаж; принимайте удобную открытую позу; спокойно подышите; думайте о приятном.
8. Физическая нагрузка.
Регулярная физическая нагрузка, направленная на: выносливость; силу; гибкость; восстановление энергетического баланса, позволит вывести лишние гормоны из организма и наполнит новым зарядом энергии.
9. Психическое расслабление (медитация; молитва; прогулки на свежем воздухе).
Успокаивайте свой ум, снижая значимость всех событий, происходящих с вами в жизни. Истинно лишь то, что остается с нами.
10. Стремитесь к балансу во всех сферах жизни.
Развивайтесь духовно, социально, интеллектуально, физически. Будьте гармоничны во всех жизненных ролях.
Вступайте в группу ВКонтакте.
https://vk.com/club164344987
Коуч, бизнес – консультант, психолог, МВА.
Энтропия что это такое: объяснение термина простыми словами

Энтропия: определение и история появления термина
История появления термина
Энтропия как определение состояния системы была введена в 1865 году немецким физиком Рудольфом Клаузиусом, чтобы описать способность теплоты превращаться в другие формы энергии, главным образом в механическую. С помощью этого понятия в термодинамике описывают состояние термодинамических систем. Приращение этой величины связано с поступлением тепла в систему и с температурой, при которой это поступление происходит.
Определение термина из Википедии
Этот термин долгое время использовался только в механической теории тепла (термодинамике), для которой оно вводилось. Но со временем это определение перешло в другие области и теории. Существует несколько определений термина «энтропия».
Википедия даёт краткое определение для нескольких областей, в которых этот термин используется:«Энтропия (от др.-греч. ἐντροπία «поворот»,«превращение») — часто употребляемый в естественных и точных науках термин. В статистической физике характеризует вероятность осуществления какого-либо макроскопического состояния. Помимо физики, этот термин широко используется в математике: теории информации и математической статистике».
Виды энтропий
Этот термин используется в термодинамике, экономике, теории информации и даже в социологии. Что же он определяет в этих областях?
В физической химии (термодинамике)

Энтропия — это мера беспорядка. Как определить беспорядок? Один из способов — приписать каждому состоянию число вариантов, которыми это состояние можно реализовать. И чем больше таких способов реализации, тем больше значение энтропии. Чем больше организованно вещество (его структура), тем ниже его неопределённость (хаотичность).
Абсолютное значение энтропии (S абс.) равно изменению имеющейся у вещества или системы энергии во время теплопередачи при данной температуре. Его математическая величина определяется из значения теплопередачи (Q), разделённого на абсолютную температуру (T), при которой происходит процесс: S абс. = Q / T. Это означает, что при передаче большого количества теплоты показатель S абс. увеличится. Тот же эффект будет наблюдаться при теплопередаче в условиях низких температур.
В экономике

В статистической физике или теории информации
Информационная энтропия (неопределённость)— это мера непредсказуемости или неопределённости некоторой системы. Эта величина помогает определить степень беспорядочности проводимого эксперимента или события. Чем больше количество состояний, в которых может находиться система, тем больше значение неопределённости. Все процессы упорядочивания системы приводят к появлению информации и снижению информационной неопределённости.
С помощью информационной непредсказуемости можно выявить такую пропускную способность канала, которая обеспечит надёжную передачу информации (в системе закодированных символов). А также можно частично предсказывать ход опыта или события, деля их на составные части и высчитывая значение неопределённости для каждой из них. Такой метод статистической физики помогает выявить вероятность события. С его помощью можно расшифровать закодированный текст, анализируя вероятность появления символов и их показатель энтропии.
Существует такое понятие, как абсолютная энтропия языка. Эта величина выражает максимальное количество информации, которое можно передать в единице этого языка. За единицу в этом случае принимают символ алфавита языка (бит).
В социологии

Энтропия: тезисно и на примерах
Пример 1. Программа Т9. Если в слове будет небольшое количество опечаток, то программа легко распознает слово и предложит его замену. Чем больше опечаток, тем меньше информации о вводимом слове будет у программы. Следовательно, увеличение беспорядка приведёт к увеличению информационной неопределённости и наоборот, чем больше информации, тем меньше неопределённость.
Пример 2. Игральные кости. Выкинуть комбинацию 12 или 2 можно только одним способом: 1 плюс 1 или 6 плюс 6. А максимальным числом способов реализуется число 7 (имеет 6 возможных комбинаций). Непредсказуемость реализации числа семь самая большая в этом случае.
Пример. Н2О (всем известная вода) в своём жидком агрегатном состоянии будет обладать большей энтропией, чем в твёрдом (лёд). Потому что в кристаллическом твёрдом теле каждый атом занимает определённое положение в кристаллической решётке (порядок), а в жидком состоянии у атомов определённых закреплённых положений нет (беспорядок). То есть тело с более жёсткой упорядоченностью атомов имеет более низкое значение энтропии (S). Белый алмаз без примесей обладает самым низким значением S по сравнению с другими кристаллами.
Пример 2. Чем выше порядок на рабочем столе, тем больше информации можно узнать о вещах, которые на нём находятся. В этом случае упорядоченность предметов снижает энтропию системы «рабочий стол».
Пример 3. Информация о классе больше на уроке, чем на перемене. Энтропия на уроке ниже, так как ученики сидят упорядочено (больше информации о местоположении каждого ученика). А на перемене расположение учеников меняется хаотично, что повышает их энтропию.
Пример. При реакции щелочного металла с водой выделяется водород. Водород-это газ. Так как молекулы газа движутся хаотично и имеют высокую энтропию, то рассматриваемая реакция происходит с увеличением её значения. То есть энтропия химической системы станет выше.
В заключение
Если объединить всё вышесказанное, то получится, что энтропия является мерой беспорядка или неопределённости системы и её частей. Интересен тот факт, что всё в природе стремится к максимуму энтропии, а человек — к максимуму информации. И все рассмотренные выше теории направлены на установление баланса между стремлением человека и естественными природными процессами.
Что означает энтропия простыми словами?
В современном мире статистическая наука является неотъемлемой частью в жизни каждого общества. Она дает возможность определить динамику развития любого явления или процесса. Одной из вероятностных статистических величин, с помощью которой можно объяснить практически все процессы человеческой жизнедеятельности как социальные, так и индвидуальные, является энтропия. Что же означает простыми словами этот многогранный термин?
Определение
Энтропия (в переводе с древнегреческого – поворот, превращение) – это мера, степень неупорядоченности (хаоса) какой-либо системы. Используется в следующих точных и естественных науках:
История возникновения
Впервые понятие энтропии было введено в эпоху развития термодинамики, когда возникла необходимость в изучении процессов, происходящих внутри термодинамических тел. В 1865 году ученый-физик из Германии Рудольф Клаузиус этим термином описал состояние системы, в котором теплота имеет способность преобразовываться в иные виды энергии (механическую, химическую, световую и т.д.).
Прирост энтропии вызван притоком тепловой энергии в систему и связан с температурой, при которой этот приток возникает. Необходимость этой величины была вызвана тем, что вся физика строится на идеализации абстрактных объектов (идеальный маятник, равномерное движение, масса и т.д.).
В бытовом понимании энтропия представляет собой степень хаотичности и неопределенности системы: чем больше в системе упорядоченности, и чем больше ее элементы подчинены какому-либо порядку, тем меньше энтропия.
Пример: Шкаф – это определенная система. Если в нем все вещи лежат на своих местах, то энтропия меньше. Если же все вещи разбросаны и лежат не на своих полках, то соответственно она становится больше.
С этим термином тесно связана тепловая функция энтальпии – характеризует состояние термодинамической системы в состоянии равновесия при выборе ряда независимых переменных, таких как давление, энтропия и число частиц.
Величина, противоположная энтропии, называется экстропией.
Виды энтропии
Рассмотрим подробнее виды энтропии в каждой из областей ее применения.
В термодинамике
В термодинамике (физической химии) энтропия – это та степень, в которой реальный процесс отклоняется от идеального. Основной постулат термодинамики, сформулированный физиками на базе изучения энтропии: каждая система термодинамики, которая изолирована от внешнего мира, постепенно становится равновесной и впоследствии не имеет возможности выйти самостоятельно из состояния равновесия. Беспорядок – основная характеристика состояния любой системы. Из него она стремится к равновесию.
Возникает вопрос: с помощью чего определить степень беспорядка?
Основной метод: каждому возможному состоянию системы присваивается число вариантных комбинаций, которыми это состояние может быть реализовано.
Вывод: чем больше число вариантов, тем больше величина энтропии. Чем больше организованности в структуре вещества, тем меньше его неупорядоченность.
Абсолютная величина энтропии равна приращению имеющейся в системе тепловой энергии в условиях теплопередачи при заданной температуре.
Клазиус определял энтропию как совокупность приведенных тепловых энергий, как функцию состояния системы, которое остается неизменным в условиях замкнутости, а в условиях открытых необратимых процессов – оно всегда положительно изменяется. Ее значение отражает связь между макро- и микросостояниями. Это единственная функциональная величина, показывающая направленность процессов. Но она не показывает сам процесс перехода состояний из одного в другое, а находится лишь исходным и итоговым состоянием системы.
В экономике
Коэффициент энтропии дает возможность проанализировать уровень концентрации рынка и его изменение. Чем этот коэффициент ниже, тем меньше неопределенность внешней среды, что ведет к повышению вероятности возникновения монополий. Этот показатель выступает в качестве косвенного помощника в оценивании выигрыша, который получает предприятие в ходе ведения монополистической деятельности или в условиях изменения рыночной концентрации (влияет на число потенциальных конкурентов фирмы).
В информатике или статистической физике
Информационная энтропия – это степень непредсказуемости информационной системы. Этот показатель служит для определения степени хаотичности эксперимента, который проводится или произошедшего события. Значение хаотичности прямопропорционально числу состояний, нахождение системы в которых возможно. Все действия, направленные на упорядочивание системы, ведут к появлению информационных сведений о ней и снижают информационную неопределенность, которая выявляет пропускную способность информационного канала, обеспечивающую надежность и достоверность передачи информационных данных. Это позволяет прогнозировать частично возможный ход эксперимента, т.е. предсказывать вероятность того или иного события.
Пример: расшифровка закодированного текста. Для этого анализируется вероятность возникновения того или иного символа и высчитывается величина их энтропии.
В социологии
Энтропия – показатель, характеризующий отклонение общественной системы или ее составных частей от заданного (образцового) состояния. Проявления этого отклонения:
Пример: персонал организации настолько загружен бумажной работой (составлением отчетов, ведением документации), что не может успевать выполнять свои должностные функции и обязанности (осуществление аудита). Мера неэффективного использования трудовых ресурсов собственником предприятия – это информационная неопределенность.
Примеры
Энтропия? Это просто!
Этот пост является вольным переводом ответа, который Mark Eichenlaub дал на вопрос What’s an intuitive way to understand entropy?, заданный на сайте Quora
Энтропия. Пожалуй, это одно из самых сложных для понимания понятий, с которым вы можете встретиться в курсе физики, по крайней мере если говорить о физике классической. Мало кто из выпускников физических факультетов может объяснить, что это такое. Большинство проблем с пониманием энтропии, однако, можно снять, если понять одну вещь. Энтропия качественно отличается от других термодинамических величин: таких как давление, объём или внутренняя энергия, потому что является свойством не системы, а того, как мы эту систему рассматриваем. К сожалению в курсе термодинамики её обычно рассматривают наравне с другими термодинамическими функциями, что усугубляет непонимание.
Так что же такое энтропия?
Энтропия — это то, как много информации вам не известно о системе
Например, если вы спросите меня, где я живу, и я отвечу: в России, то моя энтропия для вас будет высока, всё-таки Россия большая страна. Если же я назову вам свой почтовый индекс: 603081, то моя энтропия для вас понизится, поскольку вы получите больше информации. 
Почтовый индекс содержит шесть цифр, то есть я дал вам шесть символов информации. Энтропия вашего знания обо мне понизилась приблизительно на 6 символов. (На самом деле, не совсем, потому что некоторые индексы отвечают большему количеству адресов, а некоторые — меньшему, но мы этим пренебрежём). 
Или рассмотрим другой пример. Пусть у меня есть десять игральных костей (шестигранных), и выбросив их, я вам сообщаю, что их сумма равна 30. Зная только это, вы не можете сказать, какие конкретно цифры на каждой из костей — вам не хватает информации. Эти конкретные цифры на костях в статистической физике называют микросостояниями, а общую сумму (30 в нашем случае) — макросостоянием. Существует 2 930 455 микросостояний, которые отвечают сумме равной 30. Так что энтропия этого макросостояния равна приблизительно 6,5 символам (половинка появляется из-за того, что при нумерации микросостояний по порядку в седьмом разряде вам доступны не все цифры, а только 0, 1 и 2).
А что если бы я вам сказал, что сумма равна 59? Для этого макросостояния существует всего 10 возможных микросостояний, так что его энтропия равна всего лишь одному символу. Как видите, разные макросостояния имеют разные энтропии.
Пусть теперь я вам скажу, что сумма первых пяти костей 13, а сумма остальных пяти — 17, так что общая сумма снова 30. У вас, однако, в этом случае имеется больше информации, поэтому энтропия системы для вас должна упасть. И, действительно, 13 на пяти костях можно получить 420-ю разными способами, а 17 — 780-ю, то есть полное число микросостояний составит всего лишь 420х780 = 327 600. Энтропия такой системы приблизительно на один символ меньше, чем в первом примере.
Мы измеряем энтропию как количество символов, необходимых для записи числа микросостояний. Математически это количество определяется как логарифм, поэтому обозначив энтропию символом S, а число микросостояний символом Ω, мы можем записать:
Это есть ничто иное как формула Больцмана (с точностью до множителя k, который зависит от выбранных единиц измерения) для энтропии. Если макросостоянию отвечают одно микросостояние, его энтропия по этой формуле равна нулю. Если у вас есть две системы, то полная энтропия равна сумме энтропий каждой из этих систем, потому что log(AB) = log A + log B. 
Из приведённого выше описания становится понятно, почему не следует думать об энтропии как о собственном свойстве системы. У системы есть опеделённые внутренняя энергия, импульс, заряд, но у неё нет определённой энтропии: энтропия десяти костей зависит от того, известна вам только их полная сумма, или также и частные суммы пятёрок костей.
Другими словами, энтропия — это то, как мы описываем систему. И это делает её сильно отличной от других величин, с которыми принято работать в физике.
Физический пример: газ под поршнем
Классической системой, которую рассматривают в физике, является газ, находящийся в сосуде под поршнем. Микросостояние газа — это положение и импульс (скорость) каждой его молекулы. Это эквивалентно тому, что вы знаете значение, выпавшее на каждой кости в рассмотренном раньше примере. Макросостояние газа описывается такими величинами как давление, плотность, объём, химический состав. Это как сумма значений, выпавших на костях. 
Величины, описывающие макросостояние, могут быть связаны друг с другом через так называемое «уравнение состояния». Именно наличие этой связи позволяет, не зная микросостояний, предсказывать, что будет с нашей системой, если начать её нагревать или перемещать поршень. Для идеального газа уравнение состояния имеет простой вид:
Величины типа давления, температуры и плотности называются усреднёнными, поскольку являются усреднённым проявлением постоянно сменяющих друг друга микросостояний, отвечающих данному макросостоянию (или, вернее, близким к нему макросостояниям). Чтобы узнать в каком микросостоянии находится система, нам надо очень много информации — мы должны знать положение и скорость каждой частицы. Количество этой информации и называется энтропией.
Как меняется энтропия с изменением макросостояния? Это легко понять. Например, если мы немного нагреем газ, то скорость его частиц возрастёт, следовательно, возрастёт и степень нашего незнания об этой скорости, то есть энтропия вырастет. Или, если мы увеличим объём газа, отведя поршень, увеличится степень нашего незнания положения частиц, и энтропия также вырастет.
Твёрдые тела и потенциальная энергия
Если мы рассмотрим вместо газа какое-нибудь твёрдое тело, особенно с упорядоченной структурой, как в кристаллах, например, кусок металла, то его энтропия будет невелика. Почему? Потому что зная положение одного атома в такой структуре, вы знаете и положение всех остальных (они же выстроены в правильную кристаллическую структуру), скорости же атомов невелики, потому что они не могут улететь далеко от своего положения и лишь немного колеблются вокруг положения равновесия. 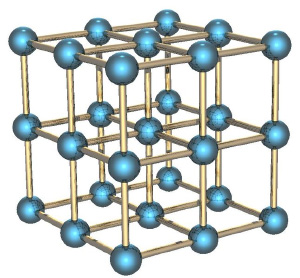
Если кусок металла находится в поле тяготения (например, поднят над поверхностью Земли), то потенциальная энергия каждого атома в металле приблизительно равна потенциальной энергии других атомов, и связанная с этой энергией энтропия низка. Это отличает потенциальную энергию от кинетической, которая для теплового движения может сильно меняться от атома к атому.
Если кусок металла, поднятый на некоторую высоту, отпустить, то его потенциальная энергия будет переходить в кинетическую энергию, но энтропия возрастать практически не будет, потому что все атомы будут двигаться приблизительно одинаково. Но когда кусок упадёт на землю, во время удара атомы металла получат случайное направление движения, и энтропия резко увеличится. Кинетическая энергия направленного движения перейдёт в кинетическую энергию теплового движения. Перед ударом мы приблизительно знали, как движется каждый атом, теперь мы эту информацию потеряли.
Понимаем второй закон термодинамики
Второй закон термодинамики утверждает, что энтропия (замкнутой системы) никогда не уменьшается. Мы теперь можем понять, почему: потому что невозможно внезапно получить больше информации о микросостояниях. Как только вы потеряли некую информацию о микросостоянии (как во время удара куска металла об землю), вы не можете вернуть её назад. 
Давайте вернёмся обратно к игральным костям. Вспомним, что макросостояние с суммой 59 имеет очень низкую энтропию, но и получить его не так-то просто. Если бросать кости раз за разом, то будут выпадать те суммы (макросостояния), которым отвечает большее количество микросостояний, то есть будут реализовываться макросостояния с большой энтропией. Самой большой энтропией обладает сумма 35, и именно она и будет выпадать чаще других. Именно об этом и говорит второй закон термодинамики. Любое случайное (неконтролируемое) взаимодействие приводит к росту энтропии, по крайней мере до тех пор, пока она не достигнет своего максимума.
Перемешивание газов
И ещё один пример, чтобы закрепить сказанное. Пусть у нас имеется контейнер, в котором находятся два газа, разделённых расположенной посередине контейнера перегородкой. Назовём молекулы одного газа синими, а другого — красными.
Если открыть перегородку, газы начнут перемешиваться, потому что число микросостояний, в которых газы перемешаны, намного больше, чем микросостояний, в которых они разделены, и все микросостояния, естественно, равновероятны. Когда мы открыли перегородку, для каждой молекулы мы потеряли информацию о том, с какой стороны перегородки она теперь находится. Если молекул было N, то утеряно N бит информации (биты и символы, в данном контексте, это, фактически, одно и тоже, и отличаются только неким постоянным множителем).
Разбираемся с демоном Максвелла
Ну и напоследок рассмотрим решение в рамках нашей парадигмы знаменитого парадокса демона Максвелла. Напомню, что он заключается в следующем. Пусть у нас есть перемешанные газы из синих и красных молекул. Поставим обратно перегородку, проделав в ней небольшое отверстие, в которое посадим воображаемого демона. Его задача — пропускать слева направо только красных, и справа налево только синих. Очевидно, что через некоторое время газы снова будут разделены: все синие молекулы окажутся слева от перегородки, а все красные — справа. 
Получается, что наш демон понизил энтропию системы. С демоном ничего не случилось, то есть его энтропия не изменилась, а система у нас была закрытой. Получается, что мы нашли пример, когда второй закон термодинамики не выполняется! Как такое оказалось возможно?
Решается этот парадокс, однако, очень просто. Ведь энтропия — это свойство не системы, а нашего знания об этой системе. Мы с вами знаем о системе мало, поэтому нам и кажется, что её энтропия уменьшается. Но наш демон знает о системе очень много — чтобы разделять молекулы, он должен знать положение и скорость каждой из них (по крайней мере на подлёте к нему). Если он знает о молекулах всё, то с его точки зрения энтропия системы, фактически, равна нулю — у него просто нет недостающей информации о ней. В этом случае энтропия системы как была равна нулю, так и осталась равной нулю, и второй закон термодинамики нигде не нарушился.
Но даже если демон не знает всей информации о микросостоянии системы, ему, как минимум, надо знать цвет подлетающей к нему молекулы, чтобы понять, пропускать её или нет. И если общее число молекул равно N, то демон должен обладать N бит информации о системе — но именно столько информации мы и потеряли, когда открыли перегородку. То есть количество потерянной информации в точности равно количеству информации, которую необходимо получить о системе, чтобы вернуть её в исходное состояние — и это звучит вполне логично, и опять же не противоречит второму закону термодинамики.