Что такое эрадикационная терапия при заболеваниях желудка
Что предлагает медицина для борьбы с Helicobacter pylori
Хеликобактерная инфекция является одной из потенциальных причин развития гастрита и язвенной болезни желудка. Роль инфекционного фактора в развитии данных заболеваний была клинически доказана. Любая терапия воспалительного процесса в области желудка окажется неэффективной без использования средств, губительно воздействующих на данный микроорганизм. Консервативная медицина использует различные схемы эрадикации хеликобактер пилори, при этом каждая схема имеет свои особенности, преимущества и недостатки.
Что такое эрадикация
Эрадикация helicobacter pylori объединяет несколько стандартных лечебных режимов, направленных на подавление жизнедеятельности данного микроорганизма. После уничтожения хеликобактерной инфекции, в слизистой оболочке желудка создаются благоприятные условия для купирования воспалительного процесса и заживление эрозивно-язвенных очагов. Любая из схем эрадикации helicobacter pylori может быть использована в том случае, если оно соответствует таким критериям:
Говоря о том, что это такое эрадикация, нельзя не упомянуть, что этот процесс даже с возможностями современной медицины является продолжительным и не всегда обеспечивает нужный результат.
Разновидности схем
Для лечения хеликобактерной инфекции используются препараты 1 и 2 линии, при этом каждая схема может иметь трехкомпонентный или четырехкомпонентный состав.
Первая линия
Трехкомпонентная схема лечения при эрадикации хеликобактер пилори, включает прием таких медикаментов:
Эффективность трехкомпонентной схемы эрадикации может быть усилена за счёт увеличения её продолжительности до 10-14 дней.
Вторая линия
Выбор схемы эрадикационной терапии при хеликобактер пилори проводится индивидуально, на основании результатов медицинского обследования.
Несмотря на то, что традиционная медицина продолжает использовать стандартные методики эрадикации хеликобактерной инфекции, этот вариант лечения продолжает находиться под сомнением, так как антибактериальные средства не только частично уничтожают бактерию, но и провоцируют ряд побочных реакций.
Полноценной альтернативой стандартным схемам лечения хеликобактерной инфекции, является метапребиотик Стимбифид Плюс, который помогает ускорить процесс эрадикации бактериальной инфекции, восстановить структуру слизистой оболочки желудка и побороть воспалительный процесс. Биодобавка одинаково эффективна при гастрите как с повышенной, так и со сниженной кислотностью.
Стандартная эрадикационная терапия хеликобактерной инфекции основана на внешнем воздействии на бактерию. Клинически доказано, что этот метод лечения является тупиковым и не гарантирует полное уничтожение микроорганизма. Принципиально новым способом является так называемое эндогенное воздействие на хеликобактер пилори посредством увеличения популяции собственной микробиоты желудка. Инновационный путь эрадикации был успешно испытан на людях-добровольцах. Метапребиотик Стимбифид Плюс помогает избавиться от хеликобактерной инфекции посредством таких механизмов:
Биодобавка одинаково эффективна как при остром, так и при хроническом течении воспалительного процесса в области желудка. Продолжительность терапии метапребиотиком Стимбифид Плюс составляет от 12 до 28 дней. В ходе клинических испытаний, спустя 30 дней после начала приёма метапребиотика, был проведён контрольный анализ на определение хеликобактерной инфекции. В 100% случаев отмечалась полная эрадикация бактерии.
Метапребиотик используется в качестве монотерапии, при этом отсутствует необходимость в дополнительном приёме препаратов из стандартных схем эрадикации. Важно помнить, что хеликобактерная инфекция является одним из потенциальных факторов развития не только гастрита и язвенной болезни желудка, но и онкологии данного органа.
Своевременная эрадикация бактериальной инфекции помогает снизить риск до минимума. При использовании стандартных методик, эрадикация хеликобактер пилори + схема лечения должна регулярно согласовываться с лечащим врачом. Используя метапребиотик Стимбифид Плюс, человек может самостоятельно проводить терапию в домашних условиях, принимая только одно средство.
К основным преимуществам использования метапребиотика Стимбифид Плюс при гастрите, ассоциированном с хеликобактер пилори можно отнести:
Эрадикация Нelicobacter pylori – пути достижения эффективности
*Пятилетний импакт фактор РИНЦ за 2020 г.
Читайте в новом номере
Представлены данные о хеликобактериозе, побочных эффектах эрадикационной терапии Нelicobacter (Н.) pylori, адъювантном варианте эрадикации.
Эрадикационная терапия не всегда является успешной, что сопряжено с растущей резистентностью штаммов Н. pylori к антибактериальным препаратам, а также с низкой комплаентностью пациентов, прекращением терапии из-за развития побочных эффектов. Использование пробиотических препаратов, в частности Lactobacillus (L.) reuteri, позволяет улучшить переносимость эрадикационной терапии, а также снизить количество и активность Н. pylori.
Применение штамма L. reuteri, обладающего выраженной антихеликобактерной активностью, в качестве адъюванта антихеликобактерной терапии представляется перспективным.
Н. pylori – неинвазивный микроб, колонизирующий преимущественно поверхностные слои слизистой оболочки (CO) желудка. Представляет собой грамотрицательную спиралевидную бактерию, имеющую на одном своем конце 4–5 жгутиков. Н. pylori сумел адаптироваться к резко кислой среде желудка благодаря небольшому размеру генома и способности к быстрым мутациям в неблагоприятных условиях для его жизнедеятельности. С помощью униполярно расположенных жгутиков Н. pylori перемещается в слое желудочной слизи в поисках оптимальных условий для колонизации CO желудка. При возникновении угрозы для существования спиралевидные формы Н. pylori трансформируются в кокковые, у которых резко снижен обмен веществ и редуцирована репродуктивная способность, но повышена устойчивость к неблагоприятным внешним воздействиям. Это позволяет им выжить при транзите через кишечник и сохраняться во внешней среде (в фекалиях, возможно, в почве и/или воде). Главным источником Н. pylori-инфекции является сам человек, а основным путем инфицирования – фекально-оральный; орально-оральный путь имеет вспомогательное значение [10, 23].
Попадая в желудок, бактерия продуцирует уреазу, которая расщепляет мочевину желудочного содержимого, вследствие чего образуются аммиак и СО2. Аммиак способствует защите микроба от соляной кислоты и вызывает повреждение СО желудка. Выделяя фермент муциназу, Н. pylori разрушает белок муцин, содержащийся в желудочной слизи, в результате чего создаются условия для проникновения бактерии через слой слизи и адгезии ее на эпителий СО желудка [4, 7].
В микробиоме желудка Н. pylori является «хозяином», хотя эффект его доминирования неясен [25]. Существует 196 штаммов Н. pylori [24]. Маркерами вирулентности Н. pylori могут служить такие гены, как cagА (способствующий индукции воспаления и секреции цитотоксичных веществ), vacА (продуцирующий вакуолизирующий цитотоксин), iceА (наиболее токсичен ice А1, способствующий адгезии Н. pylori на эпителиоцитах СО желудка) [5, 10].
Примерно 60% населения земного шара инфицировано H. рylori; распространена инфекция преимущественно в развивающихся странах, а также у пожилых. Длительное время остается асимптомной. Эффективной вакцины для предотвращения инфекции в настоящее время не существует [13, 28].
Н. pylori-инфекция является наиболее частой причиной (60–75%) развития неатрофического антрального гастрита, который постепенно (в течение 15–18 лет) может эволюционировать в антральный атрофический хронический гастрит, распространяться в антрокардиальном направлении, поражая фундальный отдел желудка, а в части случаев вызывать развитие мультифокального атрофического хронического гастрита, появление в СО желудка очагов кишечной метаплазии, эпителиальной дисплазии, неоплазии (предрака). С Н. рylori ассоциированы язвенная болезнь, реже – рак желудка и МАLТ-лимфома желудка [10, 23].
Протеазы, высвобождающиеся полиморфноядерными лейкоцитами в ответ на инфекцию Н. pylori, разрушают эпителий желез СО желудка, что в конце концов ведет к развитию атрофии [6, 15]. Кроме того, инфекция Н. pylori способствует выработке антител, которые перекрестно реагируют с париетальными клетками и могут вызвать их атрофию. В свою очередь, ахлоргидрия способствует размножению бактерий в желудке, трансформирующих нитраты в нитриты и приводящих к образованию N-нитрозосоединений, обладающих канцерогенными свойствами. Под действием Н. pylori изменяется баланс между процессами пролиферации и апоптоза, в результате чего нарушается физиологическая регенерация СО желудка, увеличивается образование свободных радикалов, аммиака, оксида азота, также обладающих канцерогенными свойствами. При длительном существовании инфекции Н. pylori возможны мутации гена р53, обеспечивающего противоопухолевую защиту, в результате чего могут появляться эпителиальные клетки с поврежденной ДНК и прогрессировать явления дисплазии эпителия. Инфекция Н. pylori приводит к снижению содержания аскорбиновой кислоты, β-каротина, α-токоферола, обеспечивающих противоопухолевую защиту [6, 14]. В 1994 г. Международным агентством по изучению рака (IARC) Н. pylori отнесен к канцерогенам 1 класса («определенно доказанным»). Наличие инфекции Н. pylori повышает риск развития рака желудка в 4–20 раз [6, 19].
Известно, что некоторые популяции с высоким уровнем инфицирования Н. pylori (в странах Восточной Азии) имеют высокую заболеваемость раком желудка, тогда как другие высокоинфицированные (в странах Южной и Западной Африки) имеют низкую частоту развития рака. Этот феномен назван «африканской загадкой» и может быть объяснен разностью генотипов Н. pylori, особенно cagА и vacА [25].
Основой лечения заболеваний, ассоциированных с Н. pylori, является эрадикация этой инфекции. Известно, что риск возникновения пептической язвы и рака желудка возрастает с повышением уровня инфицирования Н. pylori, следовательно, подавление Н. pylori-инфекции снижает риск этих заболеваний [20]. Кроме того, эрадикация Н. рylori признана наиболее перспективной стратегией снижения заболеваемости раком желудка [1, 21].
Последнее согласительное совещание «Маастрихт-4» (2010 г.) ограничило число применяемых схем эрадикации инфекции Н. pylori до 5:
– стандартная 3-компонентная терапия (ингибитор протонной помпы (ИПП) в стандартной дозе 2 р./сут + амоксициллин по 1000 мг 2 р./сут + кларитромицин 500 мг 2 р./сут в течение 7–14 дней;
– 4-компонентная терапия с препаратами висмута (ИПП в стандартной дозе 2 р./сут + тетрациклин 500 мг 4 р./сут + метронидазол 500 мг 3 р./сут + висмута трикалия дицитрат 120 мг 4 р./сут) в течение 10–14 дней;
– последовательная терапия (в течение первых 5 дней – ИПП в стандартной дозе 2 р./сут + амоксициллин по 1000 мг 2 р./сут, следующие 5 дней – ИПП в стандартной дозе 2 р./сут + кларитромицин 500 мг 2 р./сут + метронидазол 500 мг 3 р./сут;
– 4-компонентная терапия без препаратов висмута (ИПП в стандартной дозе 2 р./сут + амоксициллин 1000 мг 2 р./сут + кларитромицин 500 мг 2 р./сут + еще один антибактериальный препарат, например метронидазол 500 мг 3 р./сут) в течение 10–14 дней;
– 3-компонентная терапия с левофлоксацином (ИПП в стандартной дозе 2 р./сут + амоксициллин 1000 мг 2 р./сут + левофлоксацин 500 мг 2 р./сут) в течение 10–14 дней.
В зонах с низкой ( Литература
Только для зарегистрированных пользователей
Выбор схемы эрадикационной терапии при helicobacter pylori в случае необходимости повторного лечения
Опубликовано в журнале:
«Врач», 2008, №4, с. 64-67
Т. Лапина, кандидат медицинских наук,
ММА им. И. М. Сеченова
Лечение при инфекции Helicobacter pylori (Hp) можно считать детально разработанным: по комбинации лекарственных средств, их дозам и продолжительности курса оно стандартизировано. В России эта терапия утверждена в соответствующих стандартах медицинской помощи и Формулярной системе. Национальные рекомендации многих европейских стран и отечественные стандарты по диагностике и лечению при Нр основаны на алгоритмах, разработанных под эгидой Европейской группы по изучению этой инфекции. Поскольку первые конференции по выработке данного консенсуса прошли в Маастрихте, рекомендации носят название Маастрихтских (конференции проходили в 1996, 2000 и 2005 гг.).
Схемы эрадикационной терапии строго регламентированы, кажется, что такое лечение не должно вызывать вопросов. Однако выполнение любого стандарта на практике не всегда сопровождается стопроцентной эффективностью. Большинство наиболее острых вопросов касаются выбора схемы лечения после неудачи первой (а иногда второй и третьей) попытки.
Почему же при Нр иногда требуется проведение повторного курса эрадикационной терапии (в англоязычной литературе для его обозначения используют термин «терапия второй, третьей линии»)? В качестве показателя, свидетельствующего об оптимальности схемы лечения, все Маастрихтские рекомендации [9, 16, 17] называют 80% эрадикацию Нр. Это означает, что процент эрадикации микроорганизма по критерию intention-to-treat должен быть равен или превышать 80%. Этот «целевой» процент успешной эрадикации предложен на основании анализа данных множества клинических исследований различных схем лечения, их доступности и переносимости; он учитывает и характеристики Нр (чувствительность микроорганизма к лекарственным средствам, особенности среды обитания). Стабильно высокий процент уничтожения микроорганизма должен быть легко воспроизводим при лечении в разных популяциях и разных регионах и странах.
Решающее значение имеет, безусловно, терапия первой линии, которая должна быть нацелена на достижение эрадикации Hр у максимального числа больных. В качестве терапии первой линии Маастрихтские рекомендации III предлагают следующие трехкомпонентные схемы лечения (табл. 1): ингибитор протонной помпы в стандартной дозировке 2 раза в день+кларитромицин – 500 мг 2 раза в день+амоксициллин – 1000 мг 2 раза в день или метронидазол – 400 или 500 мг 2 раза в день. Минимальная продолжительность тройной терапии – 7 дней, однако оказалось, что для данной схемы более эффективен 14-дневный курс лечения (на 12%; 95% доверительный интервал – ДИ: 7–17%) [12]. Тем не менее 7-дневная тройная терапия может быть признана приемлемой, если местные исследования показывают, что она высокоэффективна. Рекомендуется одинаковая терапия первой линии для всех стран, хотя в разных странах могут быть одобрены разные дозы лекарственных средств [17].
Таблица 1. Схемы стандартной тройной терапии при Нр
| 1-й компонент | 2-й компонент | 3-й компонент |
| Ингибитор протонной помпы: лансопразол – 30 мг 2 раза в день или омепразол – 20 мг 2 раза в день или пантопразол – 40 мг 2 раза в день или рабепразол – 20 мг 2 раза в день или эзомепразол – 20 мг 2 раза в день | Кларитромицин – 500 мг 2 раза в день | Амоксициллин – 1000 мг 2 раза в день или Метронидазол – 400 или 500 мг 2 раза в день |
Четырехкомпонентная схема лечения включает в себя ингибитор протонной помпы в стандартной дозе 2 раза в день+висмута субсалицилат/трикалия дицитрат – 120 мг 4 раза в день+метронидазол – 500 мг 3 раза в день+тетрациклин – 500 мг 4 раза в день (табл. 2). В Маастрихтских рекомендациях II за четырехкомпонентной схемой была закреплена позиция терапии второй линии [16]. Одно из новых положений Маастрихтских рекомендаций III – возможность применения такой схемы в определенных клинических ситуациях, как терапии первой линии (альтернативная терапия первой линии) [17].
Таблица 2. Схемы четырехкомпонентной эрадикационной терапии при Нр
| 1-й компонент | 2-й компонент | 3-й компонент | 4-й компонент |
| Ингибитор протонной помпы: лансопразол – 30 мг 2 раза в день или омепразол – 20 мг 2 раза в день или пантопразол – 40 мг 2 раза в день или рабепразол – 20 мг 2 раза в день или эзомепразол – 20 мг 2 раза в день | Висмута субсалицилат/ субцитрат – 120 мг 4 раза в день | Метронидазол – 500 мг 3 раза в день | Тетрациклин – 500 мг 4 раза в день |
Почему претерпели изменения представления об оптимальной терапии первой линии в Маастрихтских рекомендациях? Почему поиск лучших режимов лечения не прекращается? Появились результаты клинических исследований стандартной тройной терапии (ингибитор протонной помпы +амоксициллин+кларитромицин) в разных странах, согласно которым «целевая» эрадикация не достигается, т.е. она ниже 80% [14]. Наиболее значимая причина снижения эффективности стандартной эрадикационной терапии – резистентность микроорганизма к антимикробным агентам. В Маастрихтских рекомендациях III большое внимание уделено вопросам планирования лечения в зависимости от чувствительности Hp к антибактериальным средствам. Так, комбинация «ингибитор протонной помпы+кларитромицин+амоксициллин или метронидазол» остается рекомендуемой терапией первой линии для популяций с частотой резистентных штаммов к кларитромицину менее 15–20%. В популяциях с частотой резистентности к метронидазолу менее 40% предпочтительнее схема «ингибитор протонной помпы+кларитроми-цин+метронидазол» [17].
Остановимся подробнее на проблеме резистентности Hp к антибиотикам. Согласно международным данным, резистентность Нр к амоксициллину либо равна 0, либо она менее 1%. Имеются крайне редкие сообщения о формировании резистентности из-за мутации pbp-1A-гена. Таким образом, резистентность к амоксициллину – крайне редкое явление, не имеющее клинического значения. Такую же редкость представляет собой резистентность к тетрациклину, которая во многих странах вообще не описана. Она обусловлена мутацией 3 смежных нуклеотидов в гене 16S rRNA (AGA 926–928→TTC). По экспериментальным данным, если мутация возникает лишь в 1 или 2 из этих нуклеотидов, резистентность клинически незначима; лишь тройственная мутация приводит к стабильной резистентности, которая способна оказать влияние на исходы лечения [18].
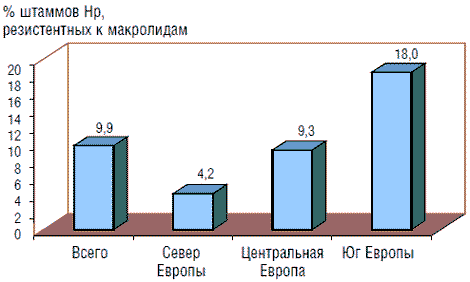
Принципиальное значение имеет чувствительность Hp к кларитромицину и метронидазолу. Количество резистентных штаммов Hp к кларитромицину, по данным мультицентрового европейского исследования, в среднем составляет 9,9% (95% ДИ: 8,3–11,7). Выявлены существенные различия этого показателя: в странах Северной Европы частота резистентности к кларитромицину низкая (4,2%; 95% ДИ: 0–10,8%); в Центральной и Восточной Европе она выше (9,3%; 95% ДИ: 0–22%) и самая высокая – на юге Европы (18%; 95% ДИ: 2,1–34,8%) (рис. 1) [13]. Риск возникновения резистентности к кларитромицину связан с частотой назначения макролидов в данной группе населения. В связи с тем что в ряде европейских стран в педиатрической практике широко назначали макролиды по поводу, например, респираторных заболеваний, частота резистентности штаммов Hp к кларитромицину у детей весьма высока, что делает проблемой выбор тактики эрадикационной терапии.
Рис. 1. Распространенность штаммов Hp, резистентных к макролидам, в европейских странах (по Glupczynski Y. и соавт., 2000)
Ответственна за резистентность к кларитромицину мутация гена 23S rDNA, которая ведет к нарушению пространственной конфигурации рибосомы. Признано, что она способствует развитию перекрестной резистентности к макролидным антибиотикам; вместе с тем не ясно, все ли макролиды, разными путями проникающие в слизистую оболочку желудка, могут приводить к селекции резистентных штаммов in vivo.
Различны и данные о влиянии резистентности к кларитромицину на исходы эрадикационной терапии. Максимальный из описанных эффектов следующий: 87,8% эрадикации Hp при наличии чувствительных штаммов, 18,3% – при наличии резистентных штаммов [18].
Количество штаммов Hp, резистентных к метронидазолу, в Европе и США колеблется от 20 до 40%. Известно, что в развивающихся странах число метронидазолрезистентных штаммов выше. Наибольшее значение для селекции резистентных штаммов имеет применение метронидазола в популяции. Механизм формирования резистентности к метронидазолу до конца не ясен: подозревают изменения гена rdxA, но точные мутации не известны [18].
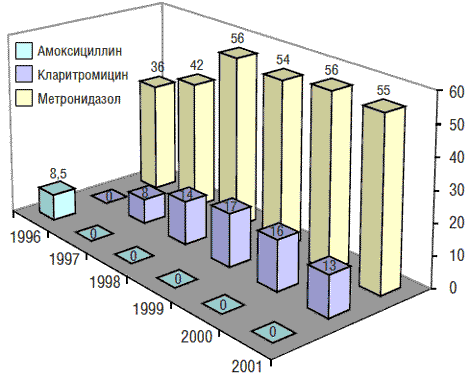
Наблюдение (1996–2001) за динамикой резистентности к производным нитроимидазола (метронидазол), макролидам (кларитромицин) и β-лактамам (амоксициллин) у штаммов Hp, выделенных в Москве, показало, что она отличается от таковой в Европе (рис. 2). Так, во взрослой популяции уровень первичной резистентности Hp к метронидазолу уже в 1996 г. превысил среднеевропейский показатель (25,5%) и составил 36,1%. На протяжении 1996–1999 гг. отмечалось увеличение числа первично резистентных штаммов Hp к метронидазолу, а затем оно не выявлялось [2].
Рис. 2. Динамика резистентности (в %) к метронидазолу, кларитромицину и амоксициллину у штаммов Hp, выделенных от взрослых в Москве в 1996–2001 гг. (Кудрявцева Л., 2004)
В отличие от данных, полученных в Европе в 1996 г., где во взрослой популяции уровень первичной резистентности Hp к макролидам (кларитромицин) составлял 7,6%, в Москве в то время штаммов Hp, резистентных к этому антибиотику, выявлено не было. Относительный прирост количества штаммов Hp, первично резистентных к кларитромицину, среди взрослой популяции за 1-й год наблюдения составил 8%, за 2-й – 6,4%, за 3-й – 2,7%. В 2000 г. уровень резистентности Hp к кларитромицину несколько снизился: если в 1999 г. он составлял 17,1%, то в 2000 г. – 16,6%. В 2001 г. наметилась явная тенденция к снижению этого показателя (13,8%).
В 1996 г. в Москве было выделено 3 штамма Hp, резистентных к амоксициллину; в дальнейшем такие находки не повторялись, и эти данные можно считать единственными в РФ и уникальными [2].
Последние доступные данные о чувствительности Hp к антибиотикам в Москве относятся к 2005 г. : у взрослых количество резистентных к метронидазолу штаммов составило 54,8%, к кларитромицину – 19,3%; у детей – соответственно 23,8 и 28,5% (Кудрявцева Л., 2006: персональное сообщение).
Таким образом, исходя из последних данных, в России сложились неблагоприятные условия для проведения стандартной тройной терапии вследствие высоких показателей резистентности Нр и к кларитромицину, и к метронидазолу. Тем не менее результаты отечественных клинических исследований свидетельствуют о большем значении для исходов терапии в нашей стране резистентности к метронидазолу, чем к кларитромицину. Чрезвычайное распространение штаммов, резистентных к метронидазолу, значительно ограничивает использование этого антибактериального агента. Так, по данным В. Ивашкина и соавт., в контролируемом исследовании схема «ингибитор протонной помпы+амоксициллин+метронидазол» (одобренная Маастрихтскими рекомендациями I и исключенная их вторым пересмотром) была успешной лишь в 30% случаев [1]. Что же касается резистентности к макролидам, то следует помнить, что контингент больных, из биопсийного материала которых были выделены штаммы для определения резистентности, был особый, в частности среди них было много стационарных пациентов. Кроме того, при анализе штаммов, полученных от лиц, проживающих в разных городах РФ, были выявлены существенные различия. Так, штаммов Hp, резистентных к кларитромицину, в Абакане зарегистрировано не было (табл. 3) [2]. Это заставляет предположить, что их распространенность за пределами Москвы и Санкт-Петербурга ниже среднеевропейского уровня.
Таблица 3. Частота антибиотикорезистентности Hp в разных городах России в 2001 г. (Кудрявцева Л. и соавт., 2004)
| Резистентность штаммов Hp | Города | ||
| Москва | Санкт-Петербург | Абакан | |
| К метронидазолу | 55,5 | 40 | 79,4 |
| К кларитромицину | 13,8 | 13,3 | 0 |
| К амоксициллину | 0 | 0 | 0 |
Не следует забывать, что обеспечивают высокий процент уничтожения Нр не только антибактериальные компоненты схемы лечения, но и ингибиторы протонной помпы. Было убедительно доказано, что без ингибитора протонной помпы при применении только 2 тех же антибиотиков в тех же дозировках эрадикация Нр снижается на 20–50%. Именно ингибиторы протонной помпы служат базисными препаратами схемы, обеспечивая путем мощного подавления желудочной секреции благоприятные условия для реализации действия антибиотиков. Если качество ингибитора протонной помпы низкое и он мало влияет на интрагастральный рН, то и процент эрадикации микроорганизма не будет достигать «целевого» рубежа. С другой стороны, высокий антихеликобактерный эффект свидетельствует об успешном контроле желудочной секреции ингибитором протонной помпы и о качестве этого лекарственного средства.
В большом числе отечественных клинических исследований продемонстрирована успешность стандартной тройной терапии даже при ее 7-дневной продолжительности. Так, в работе В. Пасечникова и соавт. (2004) больные с обострением язвенной болезни двенадцатиперстной кишки (92 человека) получали стандартную тройную терапию в течение 7 дней: Омез® (омепразол, «Д-р Редди`с Лабораторис Лтд.») в дозе 40 мг/сут в сочетании с амоксициллином (2000 мг/сут) и кларитромицином (1000 мг/сут). Затем была проведена рандомизация: пациенты 1-й группы продолжали получать омепразол (40 мг/сут) еще 2 нед; пациенты 2-й группы не получали никакого лечения. Эрадикация Hp была успешной у 82,6% больных (intention-to-treat; per protocol – 91,6%). В 1-й группе она составила 84,2% (intention-to-treat; per protocol – 92,8%), во 2-й – 82,2% (intention-to-treat; per protocol – 90,2%). Принципиальное значение имеет тот факт, что заживление язвы достигнуто у 91,5% больных, получавших монотерапию Омезом® после антихеликобактерного курса, и у 93,3% больных, получавших только недельный курс эрадикации Hp и никакого лечения в дальнейшем [4]. Таким образом, в данном исследовании 7-дневная стандартная тройная терапия способствовала достижению «целевого» процента эрадикации и более того – заживлению язвы даже без продолжения монотерапии омепразолом, что косвенно свидетельствует об эффективности антихеликобактерного курса.
Предпринимаются самые разные попытки повысить эффективность стандартной тройной терапии. Так, имеются данные о том, что сочетание антихеликобактерной схемы с пробиотиком приводит к повышению показателя эрадикации Hp и снижает частоту нежелательных явлений [10, 20]. Недавно в Москве было предпринято исследование с добавлением к стандартной тройной терапии пребиотика лактулозы (Нормазе). Омез® (40 мг/сут) в сочетании с амоксициллином (2000 мг/сут) и кларитромицином (1000 мг/сут) назначали на 12 дней и в одной группе больных сочетали с Нормазе. Эрадикация Hp в этой группе достигнута в 85% случаев, в другой – в 90% случаев (различие недостоверно). Несмотря на то что лактулоза не способствовала увеличению эрадикации Hp (процент все же превзошел «целевой» рубеж), она уменьшила частоту нарушений стула и метеоризм [3].
Терапия первой линии – стандартная тройная – не утратила актуальности для России. От точного соблюдения этого стандарта врачом и пациентом зависит успех эрадикации Нр. Чем выше ее показатель, тем меньше вероятность повторного лечения. Наиболее обоснованным способом повышения эффективности стандартной тройной терапии следует признать увеличение ее продолжительности до 14 дней [7, 11, 12].
Как надо планировать терапию второй линии при неудаче применения первой линии? Следует избегать назначения антибиотиков, которые пациент уже получал. Это – один из основополагающих (но не общепризнанных) постулатов, на которых строится такое планирование [7]. С точки зрения экспертов – авторов Маастрихтских рекомендаций III, наиболее правильным выбором в данной ситуации является квадротерапия с препаратом висмута [17]. К такому же выводу пришли и авторы Американских рекомендаций по диагностике и лечению Hp [7]. При анализе нескольких десятков клинических исследований с применением квадротерапии в качестве терапии второй линии средний показатель эрадикации микроорганизма составил 76% (60–100%) [15]. Данная схема доступна, относительно дешева и эффективна. К ее недостаткам относят большое число таблеток и капсул, которые приходится принимать ежедневно (до 18 штук в сутки), четырехкратный режим дозирования и сравнительно часто развивающиеся нежелательные явления [7].
В некоторых странах препараты висмута недоступны, и в качестве схем второй линии Маастрихтские рекомендации III предлагают варианты тройной терапии: ингибитор протонной помпы и амоксициллин, а в качестве антибактериального агента фигурируют тетрациклин или метронидазол [17]. В России нет систематизированного опыта использования таких схем, хотя имеются данные о весьма низкой эффективности 7-дневной тройной терапии: ингибитор протонной помпы+амоксициллин+метронидазол [1].
Как терапию третьей линии Маастрихтские рекомендации III позиционируют тройную терапию с представителем рифамицинов – рифабутином – и хинолонов – левофлоксацином.
В группе больных с неудавшимся курсом стандартной тройной терапии 12-дневное лечение ингибитором протонной помпы в сочетании с амоксициллином и рифабутином (150 мг) привело к эрадикации Hp в 91% случаев, причем доказанная резистентность к метронидазолу и кларитромицину не сказалась на результате [5]. Привлекательная сторона применения рифабутина – очень малая вероятность формирования резистентности к нему Hp (описана лишь в единичных случаях). Механизм формирования резистентности (перекрестной ко всем рифамицинам) – это точечная мутация rpoB-гена [18]. Маастрихтские рекомендации III настаивают на осторожном назначении этого антибиотика, так как его широкое применение может привести к селекции резистентных штаммов Mycobacteria.
Удобной в применении и достаточно эффективной кажется тройная терапия с левофлоксацином: ингибитор протонной помпы в стандартной дозе дважды в сутки в сочетании с амоксициллином (2000 мг/сут) и левофлоксацином (500 мг/сут). В качестве терапии второй линии после неудачной стандартной тройной терапии эта схема дает высокий результат [8]. Но с применением левофлоксацина связана проблема формирования резистентности к хинолонам вследствие целого ряда мутаций гена gyrA. В недавно опубликованном французском исследовании, в котором изучали большое число штаммов Hp, резистентность выявлена у 17,2% из них [6]. В работе итальянских авторов (с гораздо меньшим числом изученных штаммов) резистентность к левофлоксацину установлена в 30,3% случаев; показатель успешной эрадикации чувствительного к данному антибиотику микроорганизма – 75% против 33,3% при наличии резистентности [19].
В последних рекомендациях экспертов и обзорах по данной проблеме очень пристальное внимание уделяется новой схеме эрадикации Hp – последовательной терапии [7, 10, 11, 14]. Курс последовательной терапии занимает 10 дней: на первые 5 дней назначают ингибитор протонной помпы в стандартной дозе дважды в сутки в сочетании с амоксициллином (2000 мг/сут); затем в течение еще 5 дней – ингибитор протонной помпы в стандартной дозе дважды в сутки в сочетании с кларитромицином (1000 мг/сут) и тинидазолом (1000 мг/сут). В итальянском исследовании [21] при последовательной терапии эрадикация Hp (intention-to-treat) составила 91 против 78% в группе сравнения (10-дневная стандартная тройная терапия). В группе пациентов, инфицированных штаммами, резистентными к кларитромицину, этот показатель достиг 89 против 29%.
Для исключения неудачи в эрадикации Hp стандартную тройную терапию следует назначать в полном объеме по дозам и при возможности – на 14 дней. Выбор схем лечения в случае неудачи терапии первой линии достаточно широк и позволяет учесть индивидуальные особенности пациента.