этапы и сроки перестройки кровообращения ребенка после рождения
Этапы и сроки перестройки кровообращения ребенка после рождения
Приспособление кровообращения к внеутробному существованию, протекающее во время рождения и в течение первых нескольких дней жизни, определяется как «переходное кровообращение». Оно является сложным и ответственным периодом в процессе формирования сердечно-сосудистой системы новорожденного ребенка. Наиболее важными в послеродовой перестройке системы кровообращения являются:
— начало легочного дыхания;
— становление легочного кровотока;
— перестройка внутрисердечной и общей гемодинамики.
Начало легочного дыхания происходит следующим образом. В норме при рождении у ребенка возникают мощные сокращения диафрагмы, обеспечивающие правильное и стойкое расширение альвеол. После первых дыхательных движений легкие почти полностью расправляются. Легочные альвеолы раскрываются одновременно с увеличением кровенаполнения легких.
Становление легочного кровотока обусловлено снижением резистентности сосудов легких. После рождения сосуды легких оказываются в воздушной среде, что влечет за собой понижение внесосудистого давления, раскрытие ранее не функционировавших сосудов и расширение уже функционирующих. Установлено, что расширение артериол на уровне респираторных бронхиол происходит не сразу после рождения, а в течение первых 2—7 дней жизни.
Механическое расширение легких является не единственной причиной снижения резистентности сосудов легких. Существенными факторами этого процесса можно считать увеличение р02 и снижение рС02 в крови.
Давление крови в легочной артерии снижается не сразу: после рождения ребенка оно остается приблизительно равным давлению крови в аорте, а затем на протяжении первых часов или нескольких дней жизни медленно уменьшается. В первые часы жизни давление крови в легочной артерии равно системному АД, затем происходит его снижение до 30 мм рт. ст., что составляет примерно 1/2 от системного АД. Артериальный легочный кровоток в это время достигает уровня 4 л/мин*м2. Резистентность легочных сосудов равняется половине общего периферического сопротивления и остается умеренно увеличенной в течение последующих 2 мес.
В первые часы жизни, пока сопротивление в сосудах малого круга кровообращения довольно высокое, сохраняется сброс крови справа-налево. При снижении резистентности в легочных сосудах сброс крови меняется на лево-правый. Продолжительность становления гемодинамики малого круга кровообращения колеблется от 4 ч до конца раннего неонатального периода.
У детей, рожденных путем кесарева сечения, имеются особенности становления легочного кровообращения. Оно характеризуется более значительным легочным сосудистым сопротивлением и длительным существованием транзиторной легочной гипертензии по сравнению с младенцами, родившимися естественным путем. Кроме того, рН артериальной крови пуповины у этих детей достоверно ниже, а дефицит оснований и уровень адреналина выше, что затрудняет сердечно-легочную адаптацию.
Перестройка внутрисердечной гемодинамики осуществляется путем закрытия фетальных коммуникаций.
• Артериальный проток после рождения ребенка на некоторое время остается открытым, обеспечивая ток крови из легочной артерии в аорту. Через него в это время справо-налево шунтируется около 15% сердечного выброса. Установлено, что через 2 ч после рождения артериальный проток имеет еще достаточно большой внутренний диаметр, и конечно-диастолический объем ЛЖ в 1,2 раза больше, чем в последующие часы жизни. Изменения конечно-диастолического объема ЛЖ зависят от изменений кровотока в артериальном протоке. Установлена достоверная высокая корреляция между этими величинами. Максимальное наполнение кровью ЛЖ управляется через ограничение сократимости миокарда во время функционирования артериального протока.
Функциональное закрытие артериального протока происходит под воздействием повышающегося уровня р02 в крови и у большинства детей наступает в течение 24—72 ч после рождения. У 5% здоровых доношенных новорожденных артериальный проток в норме закрывается в течение первых 7 ч после рождения, у 50% — в течение 21 ч и у 95% младенцев — в течение 65 ч. Проток суживается одновременно в нескольких местах вследствие активного сокращения его гладкой мускулатуры, которое происходит из-за снижения синтеза простагландина Е2 в эндотелиальных клетках артериального протока, уменьшения чувствительности к нему рецепторов гладких мышц протока, увеличения концентрации кортизола и трииодтиронина в крови. Вместе с этим в ответ на гипероксию гладкомышечные клетки протока увеличивают синтез простагландина F1, который также способствует его сужению.
Эндотелий и гладкомышечные клетки легочной артерии, по сравнению с артериальным протоком и аортой, имеют более высокий уровень базального синтеза простагландинов. Гипоксемия и гипоксия уменьшают синтез простагландина Е2 и F1 в гладких мышцах легочной артерии.
Физиологические эффекты парциального напряжения кислорода и воздействия простагландинов зависят от гестационного возраста и могут осуществляться только на поздних сроках гестации и в ранние периоды внеутробнои жизни.
Кроме того, имеются и другие факторы, принимающие участие в закрытии артериального протока, такие как брадикинины, а также местные неврологические эффекты.
Этапы и сроки перестройки кровообращения ребенка после рождения
После завершения основных этапов переходного кровообращения гемодинамика ребенка относительно стабилизируется, но определенные изменения ее отдельных составляющих непрерывно происходят в течение всего неонатального периода.
Для кровообращения позднего неонатального периода характерны следующие основные характеристики:
— не функционируют фетальные коммуникации;
— имеется низкое сопротивление крови в легочных сосудах;
— давление крови в выходном тракте ПЖ и легочной артерии ниже, чем системное АД;
— желудочки сердца работают последовательно, каждый из них в отдельности накачивает половину общего сердечного выброса;
— скорость трикуспидального и трансмитрального кровотока примерно одинакова;
— происходит постепенное повышение тонуса периферических регуляторных сосудов и системного АД;
— снижается вязкость крови.
В этот период жизни ребенка имеются некоторые анатомические и функциональные особенности сердца.
Так, сердце новорожденного имеет овальную форму с преобладанием поперечных размеров. Желудочки примерно равны между собой. Диастолический диаметр ПЖ начиная со 2-х суток постепенно уменьшается, к концу первой недели жизни составляет 93% и к концу неонатального периода уменьшается до 80% от его диаметра в первые часы после рождения. Левый желудочек имеет тенденцию к уменьшению до 5—7-го дня жизни, после чего его диастолический диаметр увеличивается в течение первого месяца жизни. Предсердия и магистральные сосуды имеют большие размеры по сравнению с желудочками. Диаметр легочной артерии преобладает над диаметром аорты.
Гистологически в неонатальном периоде сердечная мышца является симпластом, состоящим из тонких, плохо разделенных миофибрилл, содержащих большое количество овальных ядер, поперечная исчерченность отсутствует. Соединительная ткань представлена незначительно, эластических элементов очень мало. Эндокард состоит из двух слоев и характеризуется рыхлым строением. Капиллярная сеть развита хорошо, с большим количеством анастомозов между коронарными артериями. В течение неонатального периода происходит постепенное утолщение миофибрилл, увеличивается объем соединительной ткани, в миокардиоцитах уменьшается количество ядер с трансформацией их в палочкообразные.
В легочных артериолах происходит постепенное увеличение их просвета, уменьшение и истончение мышечного и интимального слоев, которое завершается на 3-й неделе жизни.
Сосудистая система большого круга кровообращения отличается хорошо развитой капиллярной сетью, емкость венозного русла равна емкости артериального русла. Эластичность магистральных сосудов постепенно нарастает.
В функциональном отношении сердце новорожденного имеет ограниченную способность приспосабливаться к увеличению как постнагрузки, так и преднагрузки изза меньшей способности к растяжению миокарда желудочков.
Повышение преднагрузки у новорожденного ребенка ведет к возрастанию ударного объема крови, что при наличии высокого конечно-диастолического давления в желудочке негативно влияет на перфузию сердечной мышцы.
Если к этому добавляется высокая постнагрузка вследствие высокого периферического сосудистого сопротивления или сгущения крови, то возникает повышение систолического давления крови в желудочках с последующим снижением ударного объема.
Но несмотря на все функциональные ограничения, сердечный выброс у новорожденных детей относительно массы тела вдвое больше, чем у взрослого, а регуляция минутного объема кровообращения происходит преимущественно за счет изменения ЧСС.
Установлена зависимость конфигурации ЛЖ от состояния гемодинамики ПЖ. Левый желудочек в норме имеет округлую конфигурацию во всех фазах сердечного цикла. Небольшой конечный объем крови в ПЖ приводит к деформации формы ЛЖ в конце диастолы, с возвращением к нормальной конфигурации его в систолу. Низкая нагрузка давлением ПЖ влечет за собой изменение формы ЛЖ во всем сердечном цикле. Сочетание перегрузки давлением и объемом ПЖ также приводит к деформации ЛЖ в течение всех фаз цикла сокращения.
В неонатальном периоде изменяется диастолическая функция обоих желудочков в виде увеличения продолжительности фазы расслабления. В возрасте 16—30 дней происходит некоторое увеличение ударного и минутного объемов кровообращения. Возрастание сердечного выброса в течение первого месяца жизни является одним из механизмов адаптации сердечно-сосудистой системы, обеспечивающей благоприятные условия для быстрого роста организма ребенка.
Наряду с увеличением ударного и минутного объемов кровообращения, в течение неонатального периода постепенно возрастает и АД, величина которого зависит от массы тела ребенка. У детей с массой тела более 2,5 кг средние значения минимального и максимального АД составляют:
при рождении — 49/19 мм рт. ст.;
к концу 1-й недели жизни — 60/19 мм рт. ст.;
на 2-й неделе — 64/19 мм рт. ст.;
к концу неонатального периода — 68/20 мм рт. ст.
В периоде новорожденности имеются некоторые особенности метаболизма миокарда и реакции его на изменения кислотно-щелочного равновесия.
В частности, в митохондриях кардиомиоцитов скорость реакции и миокардиальной фракции креатинфосфаткиназы существенно увеличена. Высокая активность этого изофермента обеспечивает большую скорость синтеза АТФ и трехкратное увеличение синтеза креатин-фосфата.
Сосудорасширяющий эффект респираторного ацидоза у новорожденных более выражен, чем у взрослых. Возможно, это объясняет тот факт, что у новорожденных снижение сократительной функции миокарда при респираторном ацидозе менее значительно, чем у взрослых. Кроме того, в первые 2 нед после рождения ребенка лактат, наряду с глюкозой, является важным источником энергии для сердечной мышцы.
Этапы и сроки перестройки кровообращения ребенка после рождения
Фетальное кровообращение у новорожденных детей частично функционирует в течение 10—15 ч внеутробной жизни. В это время сохраняется небольшой кровоток через овальное окно и артериальный проток. Возможен и двухсторонний шунт с током крови справа-налево и слева-направо. Установлено, что в первые 4 ч после рождения у большинства детей двухстороннее шунтирование крови через артериальный проток имеет несколько вариантов:
1) право-левый шунт в систолу и лево-правый шунт в диастолу;
2) право-левый шунт в систолу и двухсторонний шунт в диастолу;
3) непрерывный двухсторонний шунт в систолу и диастолу.
Право-левый ток крови обычно регистрируется в раннюю систолу, лево-правый ток крови, наблюдающийся в диастолу, продолжается длительно в течение всей диастолы. Двухсторонний турбулентный кровоток через артериальный проток имеет высокую скорость и продолжительность. С возрастанием скорости кровотока по артериальному протоку в диастолу двухсторонний шунт сменяется на лево-правый. Скорость лево-правого шунта в диастолу возрастает в первые 12 ч после рождения ребенка.
Частично циркулирующие фетальные коммуникации у новорожденного ребенка играют регуляторную роль, снижая гемодинамическую нагрузку на миокард ПЖ во время послеродовой сердечно-легочной адаптации.
После рождения ребенка происходят изменения и в системе общего кровообращения. Плацентарный артериальный кровоток прекращается в течение 45—60 с после рождения. Скорость плацентарного венозного кровотока составляет 75 мл/кг-мин, замедляется через 2 мин после рождения, почти полностью прекращается на 3-й и заканчивается на 5-й минуте жизни.
Перестройка кровообращения приводит к возрастанию выброса ЛЖ примерно на 25%. В первые 2 ч после рождения резистентность периферических регуляторных сосудов низкая, в последующее время она повышается, обеспечивая таким образом необходимый уровень АД крови. В первые сутки после рождения у здоровых доношенных новорожденных наблюдается гиперкинетический тип сокращения межжелудочковой перегородки, который регистрируется до конца первой недели жизни. Такой тип сокращения межжелудочковой перегородки с высоким давлением крови в легочной артерии при транзиторной легочной гипертензии служит для облегчения работы миокарда ЛЖ. После закрытия артериального протока ударный объем ЛЖ в среднем равняется 4,0 мл, а скорость кровотока в общей системе циркуляции составляет 2,3—3,1 л/мин*м2.
Перестройка общего кровообращения сопровождается улучшением оксигенации крови и выделения углекислого газа из организма ребенка. Так, парциальное напряжение кислорода в крови в первые 10 мин жизни равняется 30 мм рт. ст., в последующие 15 мин возрастает до 60 мм рт. ст., в течение 1-го часа — до 80 мм рт. ст. и к концу первых суток жизни устанавливается на уровне 90 мм рт. ст. Парциальное напряжение углекислого газа в крови при рождении высокое (60 мм рт. ст.) и достигает уровня взрослого в течение 2-го часа жизни.
С первых по пятые сутки жизни отмечается нарастание минутного объема кровообращения, с максимальным подъемом на 3-й день после рождения. Увеличение минутного объема кровообращения происходит в значительной мере за счет возрастания ударного объема ЛЖ. Возрастание минутного объема кровообращения вместе с нормализацией общего периферического сопротивления сосудов в конечном итоге приводит к улучшению периферической циркуляции крови, увеличению кровенаполнения периферических сосудов, улучшению оттока крови из тканей и возрастанию скорости кровотока по сосудам.
После рождения постепенно повышается АД крови, особенно максимальное. Системное АД после рождения составляет в среднем 72/47 мм рт. ст., со 2—3-го дня жизни возрастает в среднем до 94/72 мм рт. ст. с наиболее значительным подъемом на 4—5-й день жизни. Возрастание системного АД связано с увеличением не только сердечного выброса, но и общего сосудистого периферического сопротивления, что обусловлено увеличением относительной массы мышечной стенки сосудистого ложа и повышением тонуса сфинктеров периферических регуляторных сосудов.
После рождения имеется устойчивая тенденция к снижению гематокрита, что также влияет на состояние общего кровотока: с уменьшением гематокрита снижается вязкость крови и возрастает скорость кровотока в общем сосудистом русле.
Метаболизм миокарда новорожденных постепенно переходит от утилизации глюкозы как основного источника энергии к потреблению жирных кислот.
Функциональное закрытие венозного протока происходит в течение первых нескольких минут жизни, а полное анатомическое закрытие — на 2—3-й неделе после рождения.
На качестве переходного кровообращения сказывается такой фактор, как время перевязки пуповины. При поздней перевязке пуповины (наложение скобок более чем через 3 мин после рождения плода) происходит возрастание объема циркулирующей крови до 60%. Этот дополнительный объем крови обеспечивает увеличение объема крови в правом и левом предсердиях («плюс-объем»), обусловливая более высокий уровень среднего АД. Среднее давление крови в предсердиях достигает исходного уровня только спустя 2—3 ч. В этом случае на сердце новорожденного ребенка падает дополнительная работа по перекачиванию большего объема крови. Кроме того, при позднем наложении скобок на пуповину происходит увеличение массы эритроцитов на 40—50%, что способствует повышению вязкости крови и, соответственно, гемодинамической нагрузки на сердце ребенка.
Переходная циркуляция сопровождается такими клиническими проявлениями, как акроцианоз, периоральный цианоз, усиливающийся при беспокойстве или крике ребенка, сердечные шумы. В первые несколько часов жизни шумы переходного кровообращения над областью сердца выслушиваются у 85% новорожденных детей. Чаще всего они обусловлены временным функционированием артериального протока с лево-правым шунтированием крови или турбулентным движением потока крови на изгибах крупных кровеносных сосудов. Отдельные сердечные шумы выслушиваются в раннюю или позднюю систолу. В первые полчаса-час после рождения на ЭКГ могут регистрироваться удлинение интервалов P-R, QRS, инверсия зубца Т в отведении VI, который в это время становится положительным за счет систолической перегрузки ПЖ.
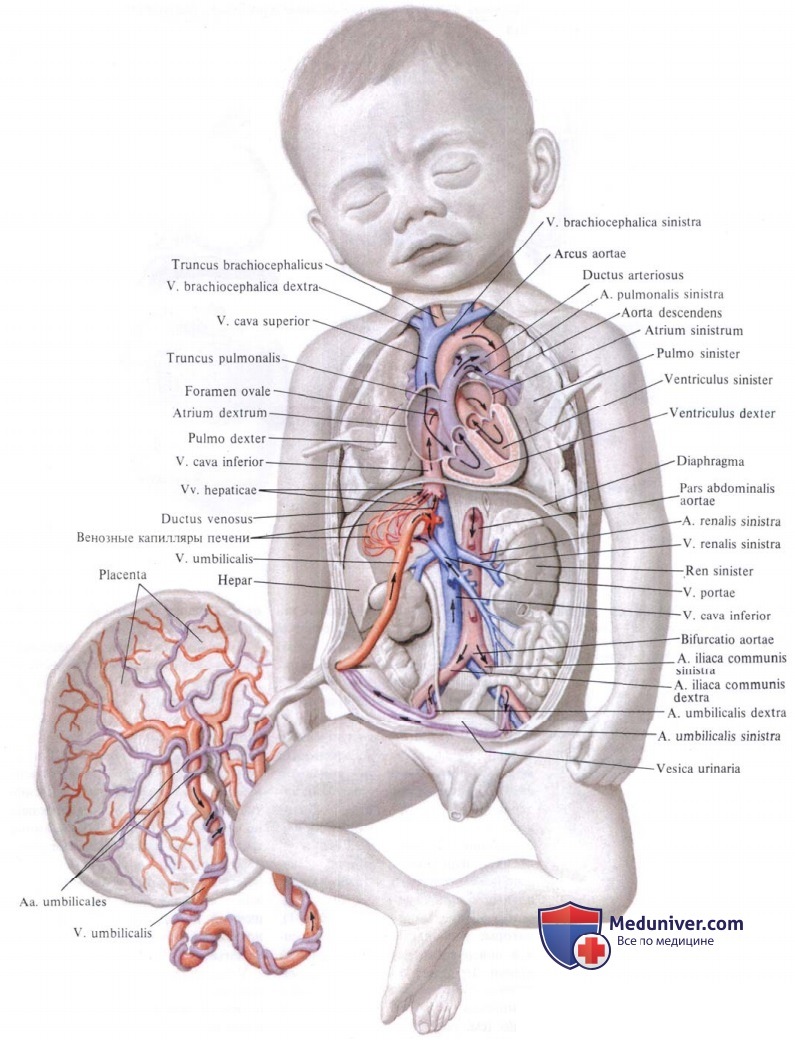
Кровообращение плода: мать и ребенок – единая система
У растущего плода существует два физиологических шунта, т.е. места сообщения между кругами. Без них развитие плода было бы невозможно. Кровь от материнской плаценты через пупочную вену плода притекает в его нижнюю полую вену, где, смешиваясь с его венозной кровью от нижней половины тела, заполняет правое предсердие. Отсюда основной поток идет через открытое овальное окно, т.е. отверстие (дефект) в межпредсердной перегородке в левое предсердие и левый желудочек и дальше – в большой круг. Это — первый физиологический, естественный шунт. Из левого желудочка часть крови идет в аорту и сосуды головы и верхней половины тела. А та часть крови, которая в правых отделах прошла в правый желудочек через трехстворчатый клапан, а затем — в легочную артерию, уходит в нисходящую аорту через второй физиологический шунт — открытый артериальный проток: нормальное соединение легочной артерии и аорты.
Это — естественные шунты, «шунты во спасение» растущего плода. Без них плод оказывается нежизнеспособным, а при их преждевременном закрытии возникают тяжелейшие врожденные пороки. В хирургии врожденных пороков сердца искусственное (временное или постоянное) создание таких шунтов является одним из широко применяющихся способов лечения. Но об этом — позже.
Оба физиологические шунта закрываются в норме вскоре после рождения, и тогда оба круга кровообращения начинают функционировать в том режиме, в котором они будут работать всю оставшуюся жизнь. Но предположим, что, помимо естественного сообщения между большим и малым кругом кровообращения на капиллярном уровне, осталось и другое, например, через отверстие в межжелудочковой или межпредсердной перегородке, или в виде не закрывшегося артериального протока.
Если такое сообщение осталось, то у потока крови из любой камеры появляются два пути: один — нормальный, т.е предусмотренный природой, второй — через дефект или через открытый шунт. Кровь будет частично течь по второму пути, поскольку туда — легче, там, в малом круге, значительно меньше сопротивление. Образуется шунт «слева — направо»: из большого круга — в малый.
Сброс слева направо
Когда определенный объем крови с каждым сокращением отклоняется от нормального пути и уходит из левых отделов в правые, то, естественно, возникают две проблемы: недостаток крови в большом круге и — переполнение круга малого. Большой круг при этом не страдает: быстро включаются сложные механизмы компенсации. А вот малому кругу приходится тяжелее.
Сброс справа налево и цианоз
Теперь представим себе противоположную ситуацию. Венозная, темная, отдавшая кислород тканям кровь, каким-то образом, минуя легкие, попадает в левые отделы сердца, в аорту и — в артериальную систему. Другими словами, у родившегося ребенка кровь циркулирует как у плода, т.е. без малого круга и дышащих легких. Но ведь материнской плаценты уже нет, а вместе с ней – нет источника кислорода. Если нет открытых путей сообщения между кругами, и венозная кровь нигде не окисляется и смешивается с артериальной, то жизнь невозможна, и ребенок будет нежизнеспособным. К счастью, так бывает очень редко. Но, если сообщение есть, то через него часть крови все же попадает в малый круг и в легкие, другая часть останется недонасыщенной. Это выразится в синюшности кожных покровов и слизистых – в цианозе. Степень цианоза может быть самой разной, как и время его видимого проявления. Он может быть слегка заметным или резко выраженным. Иногда его замечают только окружающие и врачи. Степень синюшности зависит от количества крови, которая пройдет через легкие, и от степени ее смешивания с недонасыщенной кровью в полостях сердца, т.е. от величины и уровня дефектов в его перегородках, а так же и от сопротивления кровотоку на пути из сердца в легочные артерии и альвеолы. Чем больше это сопротивление — тем меньше венозной крови попадет в малый круг и окажется в артериях, а чем больше дефект в размерах — тем лучше будет смешиваться кровь в полостях и меньше будет «синюшность».
После рождения ребенка сердце, как и при пороках со сбросом слева-направо, работает с перегрузкой, особенно его правые отделы, и мы поговорим об этом, когда будем описывать отдельные пороки. Но здесь мы хотим подчеркнуть, что само существование цианоза может быть опасным, так как недостаточное содержание кислорода в артериальной крови вызывает ее сгущение, увеличение числа эритроцитов и может привести к закупорке мелких сосудов тела, в том числе и мозга со всеми вытекающими последствиями.
Понятие о перекрестном сбросе
В некоторых ситуациях, когда дефекты в перегородках достаточно большие, а сопротивление кровотоку почти одинаковое на выходе из обоих желудочков, кровь может частично перетекать через дефект в обоих направлениях в различные фазы сердечного цикла. То есть в какой-то отрезок времени в ходе одного сокращения имеется сброс слева-направо, а в другой отрезок в ходе того же цикла, но через несколько долей секунды происходит сброс справа-налево.
В таких случаях говорят о «перекрестном сбросе», и степень недосыщения артериальной крови кислородом будет зависеть от преимущественного направления тока крови. Соответственно видимой и выраженной будет степень цианоза.
Скажем здесь, что к порокам с таким «перекрестным сбросом» относятся чаще всего очень сложные, комбинированные пороки, включающие сочетания разных нарушений развития сердца.
Препятствия кровотоку
Врожденные препятствия нормальному кровотоку обычно возникают вследствие неправильного развития в местах соединений сердечных камер друг с другом или с магистральными сосудами. Чаще всего это относится к клапанам. Сужение называют «стенозом», если оно вызвано изменением клапанов, а когда это касается аорты, то говорят о ее «коарктации».
Подробно мы разберем это ниже, но здесь хочется отметить несколько моментов, касающихся кровотока. Поскольку к восьмой неделе внутриутробной жизни плода сердце, в основном, сформировано и кровообращение уже происходит, то влияние сужения, затруднения нормальному кровотоку сказывается уже на ранних стадиях развития эмбриона. Если больше никаких дефектов нет, то желудочкам приходится работать с повышенной нагрузкой, результатом которой станет утолщение стенок, уменьшение размеров полости, недоразвитие сердечных камер. После рождения эти явления только прогрессируют и могут стать жизнеопасными уже в первые дни жизни ребенка.
Если такие препятствия сочетаются с дефектами в перегородках, то сердцу легче работать, т.к. есть другие пути для крови, в которых сопротивление меньше и поток выбирает такие пути меньшего сопротивления.
Но мы уже вплотную подошли к классификации пороков, т.е. к тому, какие пороки бывают и что при этом происходит с ребенком, справляется ли сердце с ними и каким образом.
Цитируется по книге Г. Э. Фальковский, С. М. Крупянко. Сердце ребенка. Книга для родителей о врожденных пороках сердца
Особенности кровообращения плода и его перестройка после рождения
После рождения, при пересечении пупочных сосудов, давление крови в правом предсердии резко падает, наступает гипоксия дыхательного центра, ребенок делает первый вдох, начинает работать малый круг кровообращения, рефлекторно суживается артериальный проток и через 1,5 – 2 месяца зарастает, превращаясь в артериальную связку. Овальное отверстие закрывается (к 5-6 месяцам жизни). Пупочная вена облитерируется, превращаясь в круглую связку, Аранциев проток трансформируется в венозную связку, пупочные артерии превращаются в медиальные пупочные связки.
16. Артерии: определение, функции, классификация
Артерии – это кровеносные сосуды, несущие кровь от сердца к органам.
Строение стенки артерий:
— внутренняя эластическая мембрана
— мышечного (артерии внутренних органов и артерии конечностей)
— смешанного (артерии, отходящие от аорты и легочного ствола: сонные, подключичные, подвздошные, легочные)
3. соответственно названию органа, который они кровоснабжают
4. по названию кости, к которой прилежат
5. в связи с уровнем отхождения от более крупного сосуда (брыжеечные артерии – верхняя и нижняя)
6. по направлению сосуда (arteria circum flexa femoris medialis et lateralis)
7. по глубине расположения
8. по строению средней оболочки артерии
17. Вены: определение, функции, классификация
Вены – сосуды, несущие кровь от органов к сердцу
Транспорт крови от органов к сердцу
Эвакуация от органов продуктов обмена
Циркуляция клеточных элементов крови и инкретов эндокринных желез
Обширная рефлексогенная сосудистая зона
При патологии – пути распространения опухолевых и инфекционных процессов
Интраорганные венозные сплетения выполняют роль регулятора кровотока
Использование вен в качестве трансплантатов вместо артерий
Вены волокнистого типа – эти вены очень пассивны, наружная оболочка плотно срастается с окружающими тканями, вены не спадаются (вены оболочек головного мозга, селезенки, плаценты, плечеголовные, сетчатки глаза)
Вены мышечного типа
Со слабым развитием мышечной оболочки – вены лица, шеи
Со средним развитием мышечной оболочки – вены верхней конечности
С сильным развитием мышечной оболочки – вены нижней конечности
Нижняя полая вена. Она выделена в отдельную группу, так как наружная оболочка этой вены толще внутренней и средней в 6-7 раз
18. Механизмы венозного кровотока
Принципы формирования венозного оттока:
По ковергентному принципу (слияние в единый сосуд)
По дивергентному принципу (рассыпному) – печеночная часть портальной системы, портальная система гипофиза
Вены волокнистого типа – эти вены очень пассивны, наружная оболочка плотно срастается с окружающими тканями, вены не спадаются (вены оболочек головного мозга, селезенки, плаценты, плечеголовные, сетчатки глаза)
Вены мышечного типа
Со слабым развитием мышечной оболочки – вены лица, шеи
Со средним развитием мышечной оболочки – вены верхней конечности
С сильным развитием мышечной оболочки – вены нижней конечности
Нижняя полая вена. Она выделена в отдельную группу, так как наружная оболочка этой вены толще внутренней и средней в 6-7 раз
Вены широко анастомозируют между собой, образуя венозные сплетения.
Движение крови по венам осуществляется благодаря деятельности и присасывающему действию сердца и грудной полости, в которой во время вдоха создается отрицательное давление в силу разности давления в полостях, а также благодаря сокращению скелетной и висцеральной мускулатуры органов и другим факторам. Имеет значение и сокращение мышечной оболочки вен, которая в венах нижней половины тела, где условия для венозного оттока сложнее, развита сильнее, чем в венах верхней части тела. Обратному току венозной крови препятствуют особые приспособления вен – клапаны, составляющие особенности венозной стенки. Венозные клапаны состоят из складки эндотелия, содержащей слой соединительной ткани. Они обращены свободным краем в сторону сердца и поэтому не препятствуют току крови в этом направлении, но удерживают ее от возвращения обратно. Артерии и вены обычно идут вместе, причем мелкие и средние артерии сопровождаются двумя венами, а крупные – одной. Из этого правила, кроме некоторых глубоких вен, составляют исключение главным образом поверхностные вены, идущие в подкожной клетчатке и почти никогда не сопровождающие артерий. Также существуют различные сужения и расширения вен, которые также регулируют скорость венозного кровотока.
19. Закономерности распределения артерий и вен в организме
Закономерности распределения экстраорганных артерий:
Артерии располагаются по ходу нервной трубки и нервов (аорта параллельна спинному мозгу)
Артерии туловища сохраняют сегментарное строение (межреберные сегментарные и поясничные сегментарные артерии)
Большая часть артерий располагается по принципу двусторонней симметрии. Исключение: артерии, которые развиваются из первичных брыжеек.
Артерии идут соответственно скелету человека
Артерии располагаются на сгибательных поверхностях тела
На пути к суставам от магистральных артерий отходят коллатеральные, а им навстречу от нижележащих отделов магистральных артерий – возвратные артерии
Артерии идут по кратчайшему расстоянию
Имеет значение место закладки органа, а не окончательное его положение
Артерии находятся в защищенных местах
Артерии образуют приспособления соответственно функции органа:
Сосудистые сети, кольца, дуги
Калибр артерий определяется не только размерами, но и функцией органа
Все железы внутренней секреции получают множественные источники питания
Закономерности распределения интраорганных артерий:
Эвриареальный тип (широкий)
лептоареальный тип (узкий)
длинные трубчатые кости получают: диафизарные, метафизарные, эпифизарные, апофизарные артерии
в коротких губчатых костях артерии входят с разных сторон
в органах, построенных из системы волокон, артерии входят в нескольких местах по длине органа и располагаются по ходу волокон
в органах дольчатого строения артерии входят в центре органа и расходятся соответственно долям, сегментам, долькам
в органах, закладывающихся в виде трубки:
по одной стороне органа расположена артерия, от которой отходят под прямым углом поперечные артерии, охватывающие трубку кольцеобразно
сосуды расположены параллельно длинной оси трубки и отдают ветви, идущие преимущественно продольно
сосуды образуют на поверхности трубки сеть, от которой отходят артерии в толщу органа
Закономерности распределения вен:
идут в составе сосудисто-нервного пучка
располагаются по принципу двусторонней симметрии
вены сохраняют сегментарное строение
идут по кратчайшему расстоянию
идут соответственно скелетным структурам
20 Закономерности кровоснабжения внутренних органов
Кровоснабжение паренхиматозных органов (печени, селезенки, легких, почек) существенно отличается от кровоснабжения полых органов. Таким образом, можно сказать, что сосуды органоспецифичны.
Кровоснабжение паренхиматозных органов (на примере печени).
Печень в отличие от всех других органов получает кровь из двух источников: артериальную из собственной печеночной артерии, венозную из воротной вены. Воротная вена собирает кровь от всех непарных органов брюшной полости (желудка, кишок, поджелудочной железы, селезенки и большого сальника). Войдя в ворота печени, оба сосуда (печеночная артерия и воротная вена) распадаются на долевые, сегментарные и т. д. вплоть до междольковых вен и артерий. Эти сосуды проходят вдоль боковых поверхностей классических печеночных долек вместе с междольковым желчным протоком, образуя печеночные триады. От междольковых сосудов под прямым углом отходят вокругдольковые сосуды, окружающие дольку наподобие кольца. От вокругдольковой вены начинаются синусоидные кровеносные капилляры диаметром до 30 мкм и длиной 300-500 мкм, которые следуют к центру дольки, где вливаются в центральную вену дольки. На пути следования к центральной вене синусоидные капилляры сливаются с артериальными капиллярами, которые отходят от вокругдольковой артерии. Выйдя из дольки, центральная вена впадает в поддольковую. Сливаясь друг с другом, поддольковые вены формируют более крупные венозные сосуды системы печеночных вен, которые впадают в нижнюю полую вену. Междольковые и вокругдольковые артерии являются сосудами мышечного типа. У одноименных вен мышечная оболочка развита слабо, она более развита в зоне отхождения синусоидных сосудов, где образует сфинктеры.
Кровоснабжение полых органов (на примере желудка)
К желудку, к его малой кривизне, подходя левая желудочная артерия (из чревного ствола) и правая желудочная артерия (ветвь собственной печеночной артерии). К большой кривизне желудка направляются правая желудочно-сальниковая артерия (ветвь гастродуоденальной артерии) и левая желудочно-сальниковая артерия. Ко дну желудка идут короткие желудочные артерии (ветви селезеночной артерии). Желудочные и желудочно-сальниковые артерии анастомозируют между собой в области малой и большой кривизны и образуют вокруг желудка артериальное кольцо, от которого к стенка желудка отходят многочисленные ветви. Венозная кровь от стенок желудка оттекает по одноименным венам, прилежащим к артериям и впадающим в притоки воротной вены.
21. Типы ветвления артерий
магистральный (артерии конечностей)
рассыпной (внутренняя подвздошная артерия)
смешанный (верхняя брыжеечная артерия)
22. Коллатеральный кровоток, функциональная роль.
Коллатеральное кровообращение – важное функциональное приспособление организма, связанное с большой пластичностью кровеносных сосудов и обеспечивающее бесперебойное кровоснабжение органов и тканей.
Под коллатеральным кровообращением понимается боковой, окольный ток крови, осуществляющийся по боковым сосудам. Он совершается в физиологических условиях при временных затруднениях кровотока (например, при сдавлении сосудов в местах движения, в суставах). Он может возникнуть и в патологических условиях при закупорке, ранениях, перевязке сосудов при операциях и т. п.
В физиологических условиях окольный ток крови осуществляется по боковым анастомозам, идущим параллельно основным. Эти боковые сосуды называются коллатералями. При затруднении кровотока по основным сосудам, вызванном их закупоркой, повреждением или перевязкой при операциях, кровь устремляется по анастомозам в ближайшие боковые сосуды, которые расширяются и становятся извитыми, сосудистая стенка их перестраивается за счет изменения мышечной оболочки и эластического каркаса и они постепенно преобразуются в коллатерали иного строения, чем в норме. Таким образом, коллатерали существуют и в обычных условиях, и могут развиваться вновь при наличии анастомозов. Следовательно, при расстройстве обычного кровообращения, вызванном препятствием на пути тока крови в данном сосуде, вначале включаются существующие обходные кровеносные пути – коллатерали, а затем развиваются новые. В результате нарушенное кровообращение восстанавливается. В этом процессе важную роль играет нервная система.
Таким образом, коллатераль – боковой сосуд, осуществляющий окольный ток крови. Коллатерали бывают двух родов. Одни существуют в норме и имеют строение нормального сосуда, как и анастомоз. Другие развиваются вновь из анастомозов и приобретают особое строение. Для понимания коллатерального кровообращения необходимо знать те анастомозы, которые соединяют между собой системы различных сосудов, по которым устанавливается коллатеральный ток крови в случае ранний сосудов, перевязки при операциях и закупорки (тромбоз и эмболия).
Анастомозы между ветвями крупных артериальных магистралей, снабжающих основные части тела (аорта, сонные артерии, подключичные артерии, подвздошные и т. п.) и представляющих как бы отдельные системы сосудов, называются межсистемными. Анастомозы между ветвями одной крупной артериальной магистрали, ограничивающиеся пределами ее разветвления, называются внутрисистемными. Имеются анастомозы и между тончайшими внутриорганными артериями и венами – артериовенозные анастомозы. По ним кровь течет в обход микроциркуляторного русла при его переполнении и, таким образом, образует коллатеральный путь, непосредственно соединяющий артерии и вены, минуя капилляры. Кроме того, в коллатеральном кровообращении принимают участие тонкие артерии и вены, сопровождающие магистральные сосуды в сосудисто-нервных пучках и составляющие так называемое околососудистое и околонервное артериальное и венозное русло.
23. Микроциркуляторное русло, составные части
щели, каналы, промежуточные интерстициальные ткани
общебиологическая – обмен веществ
клиническая – развитие любого воспаления
24. Онтогенез крупных артериальных сосудов