как найти отношение массы
Масса тела. Единицы массы
Содержание
Когда два тела взаимодействуют друг с другом, их скорости могут меняться. Что мы здесь имеем в виду? Тела могут останавливаться, разгоняться, замедляться, могут начать двигаться в другом направлении.
Опытное рассмотрение взаимодействия тел разной массы
В прошлом уроке мы рассматривали опыт с двумя тележками, к одной из которых была прикреплена гибкая металлическая пластина. Проведем похожий опыт (рисунок 1). На одну из тележек установим груз (рисунок 1,а).

Красной линией отмечено исходное положение тележек. После того, как мы разрежем нить, скрепляющую пластину, тележки разъедутся в разные стороны. Но теперь мы ясно видим, что тележка с грузом откатилась на меньшее расстояние, чем тележка без груза (рисунок 1, б).
Логично, что та тележка, которая прошла меньший путь, имела меньшую скорость. Но это была тележка с грузом. Тележка, движущаяся с меньшей скоростью, обладает большей массой, а тележка с большей скоростью обладает меньшей массой.
Скорости, приобретенные телами после взаимодействия друг с другом, зависят от их массы.
Соотношение масс и приобретенных после взаимодействия скоростей
Мы можем измерить скорости тележек после взаимодействия и сравнить их массы. Опытным путем было установлено соотношение:
т.к. скорость второй тележки в 2 раза больше скорости первой, то ее масса будет в 2 раза меньше массы первой тележки.
Тогда, если после взаимодействия
Инертность и масса тела
Когда мы разбирали определении инерции (способность сохранять скорость тела при отсутствии действия на него других тел), мы упоминали понятие инертности. Рассмотрев взаимодействие тел друг с другом и изменение скорости, теперь мы можем дать полное определение и этому понятию.
Инертность – это индивидуальное свойство каждого тела по-своему менять свою скорость при взаимодействии с другими телами:
Масса тела – это физическая величина, которая является мерой инертности тела.
Единицы измерения массы
Единица массы в СИ – килограмм (1 кг).
Существует так называемый “эталон” – цилиндр из сплава платины и иридия весом ровно 1 кг. Международный эталон был выпущен в 1889 году и хранится в Международном бюро мер и весов в городе Севре (близ Парижа). Хоть он и хранился под герметичными колпаками (рисунок 2), его вес менялся, теряя примерно по 50 микрограммов за 100 лет. Но с 20 мая 2019 года он перестал был значимым. Теперь эту единицу (кг) определяют через физическую константу – постоянную Планка, о которой вы узнаете в старших классах.
Рисунок 2. Эталон килограмма.
Другие используемые единицы массы: тонна (т), грамм (г), миллиграмм (мг):
Примеры задач
Дано:
$m_р = 9 кг$
$\upsilon_р = 1,3 \frac<м><с>$
$\upsilon_п = 800 \frac<м><с>$
Показать решение и ответ
Решение:
Запишем соотношение масс и скоростей взаимодействующих тел:
$\frac
Дано:
$m_м = 40 кг$
$\upsilon_м = 4 \frac<м><с>$
$m_л = 100 кг$
Показать решение и ответ
Решение:
Запишем соотношение масс и скоростей взаимодействующих тел:$$\frac<\upsilon_л> <\upsilon_м>= \frac
Как найти отношение массы
Инертность, которой обладает каждое тело, — одно из важнейших его свойств, потому что от нее зависит ускорение тела в результате его взаимодействия с другими телами.
Всякое свойство тел выражается определенной величиной. Например, свойство тел занимать часть пространства выражается величиной его объема. Свойство тел, которое мы назвали инертностью, тоже выражается особой величиной. Такой величиной является масса. С этой величиной вы ознакомились в курсе физики VI класса.
То из двух взаимодействующих тел, которое получает меньшее ускорение, т. е. более инертно, имеет большую массу. Если обозначить массы взаимодействующих тел через 
Отношение абсолютных значений ускорений двух взаимодействующих тел равно обратному отношению их масс.
Мы, например, видели, что отношение ускорения алюминиевого цилиндра к ускорению стального равно трем. Это вызвано тем, что масса алюминиевого цилиндра в три раза меньше массы стального цилиндра.
Таким образом, мы теперь знаем, как найти отношение масс двух тел. Для этого нужно измерить их ускорения при взаимодействии. А как найти массу каждого отдельного тела? Здесь поступают так же, как и при измерении других величин.
Чтобы, например, найти число, выражающее обьем тела, мы сравниваем его с некоторым объемом, условно принятым за единицу, — с кубическим метром. Таким же способом определяют численные значения масс: чтобы найти число, выражающее массу отдельного тела, нужно сначала выбрать какое-нибудь тело, массу которого условно принимают за единицу, — эталон массы. Затем нужно провести опыт, в котором тело, масса которого определяется (измеряется), как-то взаимодействовало с эталоном массы (см. рис. 81). Тогда оба они, и тело, и эталон, получат ускорения, которые можно измерить, и мы сможем написать равенство
где 


Масса тела — это величина, выражающая его инертность. Она определяет отношение ускорения эталона массы к ускорению тела при его взаимодействии с эталоном.
Совершенно безразлично, какое именно тело принять за эталон массы. Нужно только условиться, чтобы эталон был одним для всех стран. На Международном конгрессе в 1889 г. в качестве эталона массы была принята масса специально изготовленного цилиндра из сплава платины и иридия. Масса этого цилиндра и есть международная единица массы — килограмм (сокращенно: кг). Эталон массы хранится в Международном бюро мер и весов (во Франции). В СССР, как и в некоторых других странах, имеется точная копия этого эталона. С большой точностью можно считать, что массой в 1 кг обладает 
Масса наряду с такими величинами, как длина и время, входит в число основных величин систем единиц СИ и СГС. В системе единиц СГС за единицу массы принимается грамм (сокращенно: г): 1 г = 0,001 кг.
Не следует думать, что каждый раз, когда нужно измерить массу какого-нибудь тела, его заставляют взаимодействовать с эталоном массы и измеряют ускорения тела и эталона. Такой способ практически, конечно, неудобен. Существует, к счастью, другой способ измерения массы — в звешивание, которым обычно и пользуются. Но в некоторых случаях определение массы по ускорениям при взаимодействии является единственно возможным способом. Нельзя, например, взвешиванием измерить массу планет, звезд и других небесных тел. На весах нельзя также измерять очень малые массы, например массы атомов и частиц, из которых они состоят.
Масса тела выражает его собственное свойство (инертность), которое не зависит ни от того, в каких взаимодействиях тело участвует, ни от того, как оно движется. Что бы с телом ни происходило, где бы оно ни находилось, как бы оно ни двигалось, масса его остается одной и той же.
Об одном интересном и важном свойстве массы можно узнать, если поставить еще один опыт (рис. 83). Соединим вместе два алюминиевых цилиндра и повторим опыт с центробежной машиной (см. § 30). Теперь стальной цилиндр взаимодействует не с одним, а о двумя соединенными вместе алюминиевыми цилиндрами.
Опыт покажет, что отношение ускорения соединенных вместе двух алюминиевых цилиндров к ускорению стального цилиндра равно не 3, а 3/2.
Это значит, что масса двух цилиндров, соединенных вместе и ставших как бы одним телом, вдвое больше массы
одного из них. Следовательно, когда два или несколько тел соединяются в одно, их массы складываются.
Из-за этого свойства массы иногда говорят, что масса выражает собой и количество вещества в теле. Ясно ведь, что в двух алюминиевых цилиндрах вдвое больше алюминия, чем в одном.
Мы говорили, что масса тела не зависит от того, как движется тело. Но это не совсем верно. Теория относительности приводит к поразительному выводу, что масса тела все же зависит от того, как оно движется. Оказывается, масса тела на самом деле растет с увеличением его скорости. Допустим, что масса некоторого покоящегося тела равна 


где с — скорость света. Масса тела, следовательно, стала больше. Однако заметным это увеличение массы становится только при скоростях, близких к скорости света 
1. Может ли скорость тела изменяться мгновенно?
2. В чем состоит свойство, называемое инертностью тела?
3. Какой величиной характеризуется инертность тела?
4. Какова связь между массами тел и ускорениями, которые они получают при взаимодействии?
5. Как определяется численное значение массы тела?
6. В каких единицах измеряется масса?
7. Покупатель приобрел в магазине 2 кг хлеба. Что выражает число 2 кг?
8. Тележка движется по горизонтальной поверхности со скоростью 50 с мсек. С ней сталкивается вторая тележка, которая движется в том же направлении со скоростью 150 см/сек. После столкновения обе тележки продолжают движение в прежнем направлении с одинаковой скоростью 100 см/сек. Найдите отношение масс этих тележек.
Плотность вещества
Масса
Начнем с самого сложного — с массы. Казалось бы, это понятие мы слышим с самого детства, примерно знаем, сколько в нас килограмм, и ничего сложного здесь быть не может. На самом деле, все сложнее.
В Международном бюро мер и весов в Париже есть цилиндр массой один килограмм. Материал этого цилиндра — сплав иридия и платины. Его масса равна одному килограмму, и этот цилиндр — эталон для всего мира.
Высота этого цилиндра приблизительно равна 4 см, но чтобы его поднять, нужно приложить немалую силу. Необходимость эту силу прикладывать обуславливается инерцией тел и математически записывается через второй закон Ньютона.
Второй закон Ньютона
F = ma
В этом законе массу можно считать неким коэффициентом, который связывает ускорение и силу. Также масса важна при расчете силы тяготения. Она является мерой гравитации: именно благодаря ей тела притягиваются друг к другу.
Закон Всемирного тяготения
F = GMm/R2
M — масса первого тела (часто планеты) [кг]
m — масса второго тела [кг]
R — расстояние между телами [м]
G — гравитационная постоянная
G = 6.67 × 10-11 м3 кг-1 с-2
Когда мы встаем на весы, стрелка отклоняется. Это происходит потому, что масса Земли очень большая, и сила тяготения буквально придавливает нас к поверхности. На более легкой Луне человек весит меньше в шесть раз. Когда думаешь об этом, хочется взвешиваться исключительно на Луне🙃
Откуда берется масса
Физики убеждены, что у элементарных частиц должна быть масса. Доказано, что у электрона, например, масса есть. В противном случае они не могли бы образовать атомы и всю видимую материю.
Вселенная без массы представляла бы собой хаос из различных излучений, двигающихся со скоростью света. Не существовало бы ни галактик, ни звезд, ни планет. Здорово, что это не так, и у элементарных частиц есть масса. Только вот пока непонятно, откуда эта масса у них берется.
Мужчину на этой фотографии зовут Питер Хиггс. Ему мы обязаны за предположение, экспериментально доказанное в 2012 году, что массу всех частиц создает некий бозон.
Бозон Хиггса невозможно представить. Это точно не частица в форме шарика, как обычно рисуют электрон в учебнике. Представьте, что вы бежите по песку. Бежать ощутимо сложно, как будто бы увеличилась масса. Частицы пробираются в поле Хиггса и получают таким образом массу.
Объем тела
Объем — это физическая величина, которая показывает, сколько пространства занимает тело. Это важный навык — уметь объемы соотносить. Например, чтобы посчитать, сколько пластиковых шариков помещается в гигантский бассейн.
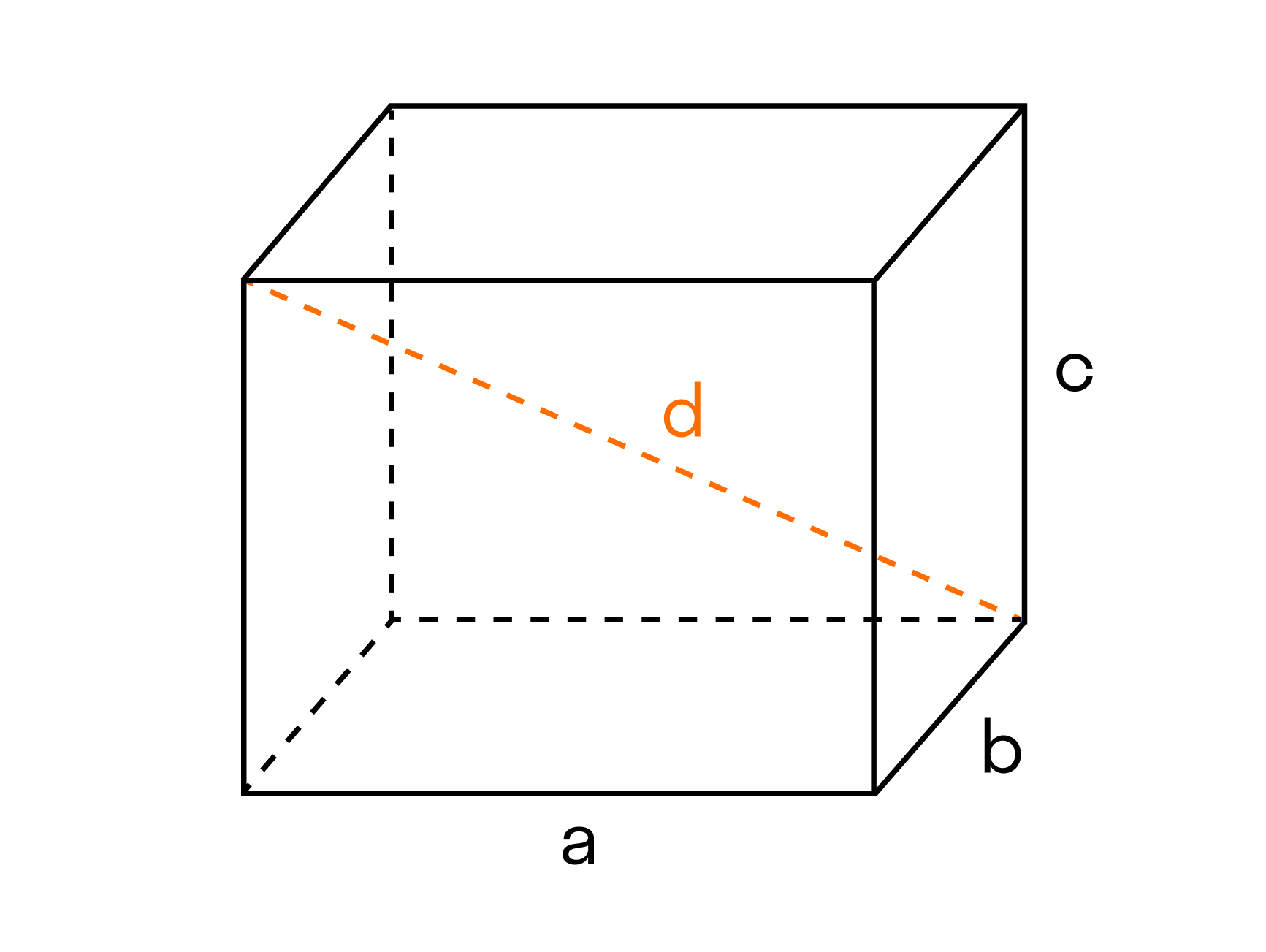
Например, чтобы рассчитать объем прямоугольного параллелепипеда, нам нужно перемножить три его параметра.
Формула объема параллелепипеда
V = a*b*c
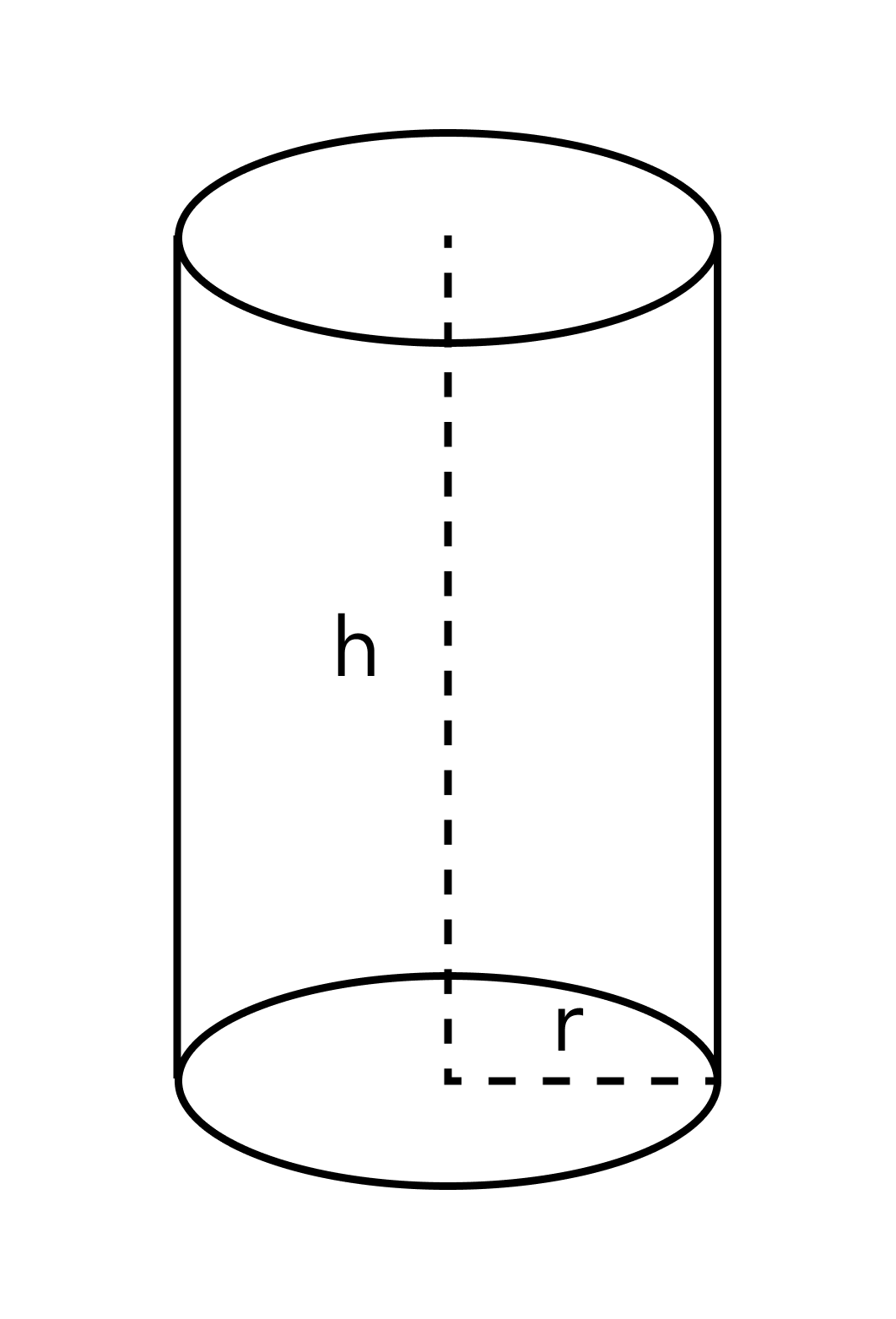
А для цилиндра будет справедлива такая формула:
| 9 класс [16] |
| 11 класс [5] |
| Лаборатория [7] |
| Переменка [6] |
| Решение задач [9] |
| Учебные пособия [5] |
Форма входа
Приветствую Вас Гость!
Поиск
Друзья сайта
Наш опрос
Статистика
Как вам известно, чтобы написать формулу вещества используют знаки химических элементов и цифры – индексы, которые показывают количество каждого из элементов в 1 моле вещества. Значит, чтобы вывести формулу вещества, необходимо установить, какие элементы входят в его состав и в каком количестве. Поэтому, при установлении формулы находят количество каждого из элементов с помощью данных задачи и определяют их соотношение.
Решим задачу: 10 г кальция сожгли в кислороде. После реакции получился оксид кальция массой 14 г. Рассчитайте формулу оксида.
Исходя из условия, определяем массу кислорода в оксиде:
m (О) = m ( CaO ) — m ( Ca ) = 14г — 10г = 4г
Определяем количества кальция и кислорода, используя формулу для нахождения количества вещества через массу.
n ( Ca ) = 10г/ 40 г/моль = 0,25моль
n ( O ) = 4г / 16 г/моль = 0,25 моль
Следовательно, отношение количества кальция и кислорода в оксиде кальция составляет n ( Ca ): n ( O ) = 0,25 : 0,25, или, в целых числах, 1:1. Значит, химическая формула оксида кальция — СаО.
Ответ: формула оксида кальция СаО.
1. Определите химическую формулу оксида серы, если известно, что в этом оксиде на 8г серы приходится 8г кислорода.
2. Известно, что азот образует несколько оксидов. В лаборатории было получено два оксида азота. Опытным путем установили, что в первом оксиде на 7г азота приходится 4г кислорода, во втором – на ту же массу азота – 16 г. Установите формулы оксидов.
3. Химик провел анализ некоего вещества и установил, что в исследуемом образце содержится 5,4 г алюминия и 21,3 г хлора. Какова химическая формула этого вещества? Дайте ему название.
4. В быту часто употребляют растворитель ацетон, жидкость с характерным запахом. В ацетоне на 9 г углерода приходится 1,5 г водорода и 4 г кислорода. Какова химическая формула ацетона?
Для расчета количества вещества необходимо знать массу. Чтобы перейти от массовых долей к граммам, примем массу образца за 100 г, тогда числовые значения доли в % совпадут с числовым значением массы элемента в образце. Затем решаем задачу по массовому соотношению элементов.
Решим задачу: Карбонат натрия (сода) содержит 11,3% углерода, 43,4 % натрия и 45,3% кислорода. Определите формулу карбоната натрия.
Примем массу образца карбоната натрия за 100г. Исходя из условия, определяем массы элементов в образце:
Определяем количества вещества каждого химического элемента по формуле n = m / M
n ( Na ) = 43,4 г / 23 г/моль = 1,89 моль
n ( C ) = 11,3 г / 12 г/моль = 0,94 моль
n (О) = 45,3 г/ 16 г/моль = 2,83 моль
Следовательно, отношение количества натрия, углерода и кислорода в карбонате натрия составляет n ( Na ): n ( C ): n ( O ) = 1,89 : 0,94: 2,83, Чтобы выразить соотношение в целых числах, разделим каждое число на наименьшее ( на 0,94).
Значит, химическая формула карбоната натрия — Na 2 CO 3.
В состав перманганата калия (в быту называемого марганцовкой) входит 24,7% калия, 34,8% марганца, 40,5% кислорода. Определите формулу перманганата калия.
Главная > Решение
| Информация о документе |
| Дата добавления: |
| Размер: |
| Доступные форматы для скачивания: |
Типы расчетных задач
I. Вывод химических формул.
I. Нахождение химической формулы вещества по массовым долям элементов
Задача. Элементный состав вещества следующий: массовая доля элемента железа 0.7241 (или 72,41%), массовая доля кислорода 0,2759 (или 27,59%). Выведите химическую формулу.
Решение. 1) Находим отношение числа атомов:
Fe: О =72,41/56 ==27,59/16 1,29:1,72
2) Меньшее число принимаем за единицу и находим следующее отношение:
3) Так как должно быть целое число атомов, то это отношение приводим к целым числам:
2. Нахождение химической формулы по отношение масс элементов,
входящих в состав данного вещества.
Задача. Найдите химическую формулу вещества, в состав которого входит 9 мае. ч. алюминия и 8 мае. ч. кислорода.
Решение. Находим отношение числа атомов:
Аl: О = 9/27:8/16 = 0,33:0.5 = 0,99:1,5 2:3
Ответ. Химическая формула данного вещества Аl 2 Оз.
3. Нахождение химической формулы вещества по массовым долям элементов, если указана плотность или относительная плотность данного вещества в газообразном состоянии.
Задача 1. Экспериментально установлено, это элементный состав газообразного вещества следующий: массовая доля углерода 0,8571 (или 85,71%), массовая доля водорода 0,1429 (или 14,29%). Масса 1 л этого газа при нормальных условиях составляет 1,25 г. Найдите химическую формулу данного вещества.
Решение. 1) Находим отношение числа атомов элементов:
С : Н = 85,71/12:14,29/1 = 7,14:14,29 1:2
2) Находим молярную массу по простейшей формуле
М (СН 2 ) = 12 + 2 = 14 г/ моль.
3) Чтобы выяснить, какая из этих формул соответствует данному газу находим молярную массу по плотности:
Ответ. Химическая формула исследуемого вещества С 2 Н 4 ( этилен).
Задача 2. При сгорании 2,3 г вещества образуется 4,4 г оксида углерода (IV) и 2,7 г воды. Плотность паров этого вещества по воздуху равна 1,59. Определите молекулярную формулу данного вещества.
Решение. Так как при сгорании данного вещества образуются оксид углерода (IV) и вода. то из этого следует, что в состав данного вещества входят углерод и водород.
1) Находим массу углерода:
44 г СО 2 содержат 12 г С
44:4,4=12:х 1 ; х 1 = 
2)Находим массу водорода:
18 г Н 2 О содержат 2г H
18:2,7 ==2:Х 2 ; X 2 =
3) Если в исследуемом веществе содержится кислород, то его находят по разности массы вещества и суммы масс углерода и водорода:
m (С) + m (Н) =1,2 г + 0,3 г = 1,5 г;
m(0)= 2,3 г — 1,5 г = 0,8 г
4) Находим отношение числа атомов элементов:
С:Н:0 = 1,2/12:0,3/1:0,8/16 = 0,1:0,3:0,05 = 2:6:1
Следовательно, простейшая формула этого вещества С 2 Н 6 О.
5) Находим молярную массу исследуемого вещества по простейшей формуле и по относительной плотности его паров по воздуху:
М(С 2 Н 6 О)=46 г/моль;
М=29·D возд. = 29-1,59= 46,11; М=46,11 г/моль
В данном случае простейшая формула С 2 Н 6 О является истинной.
Ответ. Химическая формула вещества С 2 Н 6 О.
II. Расчеты по химическим формулам.
Задача. Найдите отношение масс элементов в гидроксиде кальция.
Решение. 1) Находим молярную массу гидроксида кальция:
М(Са(ОН) 2 )= 40+(16 +1)·2=74; М =74 г/моль
2) Находим отношение масс кальция, кислорода и водорода:
Ответ: отношение масс кальция, кислорода и водорода в гидроксиде кальция равно 20:16:1.
2. Нахождение содержания массовых долей элементов в сложном веществе.
Задача. Вычислите массовые доли элементов в гидроксиде натрия. Решение. 1) Находим молярную массу гидроксида натрия:
M(NaOH)=23+16+l=40; М(NaOH)=40 г/моль
2) Вычисляем массовую долю натрия:
w (Na) = 23/40 =0,575 маc. д., или 57.5%
3) Вычисляем массовую долю кислорода:
w (О) =16/40=0.4 маc. д., или 40%
4) Вычисляем массовую долю водорода:
w (Н)= 1/40=0,025 маc. д, или 2,5%
5) Проверяем правильность вычисления:
0,575+0,4+0,025=1,00 (в мас. д.);
Ответ. Элементный состав NaOH следующий: массовая доля натрия 0,575 (или 57,5%), массовая доля кислорода 0,4 (или 40%) и массовая доля водорода 0,025 (или 2,5%).
Примечание. Содержание водорода можно также вычислить по разности:
w (Na) + w (О) = 0,575 + 0,4 = 0.975;
w (H) = 1,0 — 0,975 = 0,025;
w% (Na) + w% (О) = 57,5 + 40 = 97,5;
3. Нахождение массы элемента по известной массе сложного вещества Задача. Вычислите, сколько алюминия содержат 408 т оксида алюминия.
Решение. 1) Находим молярную массу оксида алюминия:
А1(А1 2 0з)=27,2+16-3=102; М (А1 2 0з)=102 г/моль;
2) вычисляем массу алюминия, содержащуюся и 408 т оксида алюминия:
102 т Аl 2 Оз содержат 54 т А1
102:408=54:x. x=
(Здесь и далее вычисление ведется и тex единицах массы, которые указаны в условиях задач.)
Вычисление можно производить и так :
m(Al)=m(Al 2 O 3 )

Ответ: 408 т Al 2 O 3 содержат 216 т Al/
Примечание. Если в условии задачи дано вещество с примесью, тогда предварительно вычисляют массу чистого ветества, содержащуюся в смеси. Затем поступают, как указано выше.
4. Нахождение массы сложного вещества но заданной массе элемента.
Задача. В какой массе оксида меди (II) содержится 3,2 т меди?
Р е ш e н и е, I) Находим молярную массу оксида меди (II):
М (CиО)= 64+ 16 =8О, М(CиO)=80 гмоль
2) Вычисляем массу оксида меди (II):
64 т Си содержится в 8О т СиO
64:3,2 =80: х; х=
Ответ. 3,2 т Си содержится в 4 т CuO.
III. Расчеты с использованием понятия «моль».
I. Вычисление количества вещества, соответствующего определенной массе вещества.
Задача I. Дано 32 г меди. Bычислитe количество меди.
Р е ш е н и е. Пользуясь формулой v= 
m — масса вещества, М — молярная масса данного вещества, находим кoличество вещества меди:
v =m/M=3264=0,5 v (Cи) = 0,5 моль
Можно рассуждать и так:
64 г меди составляют 1 моль
64:32=1 : х =
0твет: 32г меди составляют 0,5 моль.
Задача 2. Какое количество вещества cocтавляют 66 г оксида углерода (IV)?
Р е ш е н и е. I) Находим молярную массу оксида углерода (IV)
2) Вычисляем количество вещества оксида углерода (IV);
v = m/М = 64/44 = 1,5; v (CO 2 ) = l,5 моль
О т в ет : 66 г оксида углерода (IV) составляют 1.5 моль.
Задача 1. Дано 0,25 моль серы. Вычислите массу серы.
v= mM; m= v ·М =0,25· 32=8 ; m(S)= 8 г
0 т ве т. 0,25 моль серы соответствуют 8 г серы.
Задача 2. Дано 2 моль серной кислоты. Вычислите массу серной кислоты
Р е ш е н и е I) Вычисляем молярную массу серной кислоты:
М(Н 2 SO 4 ) = 98 г/моль
2) Определяем массу серной кислоты:
v = mM; m = v·M=2·98=196; m(H 2 SO 4 )=196 г
О т в е т. 2 моль серной кислоты соответствуют 196 г серной кислоты.
3. Вычисление числа атомов и молекул, содержащихся в определенной
Задача I. Сколько атомов содержится в 20 г кальция?
Р е ш е н и е. 1 ) Вычисляем количество вещества, cоответствующее 20 г кальция:
v = m/M= 20/40=0,5. v(Ca)=0.5 моль
2) Вычисляем число атомов кальция:
1 моль содержит 6,02·10 23 атомов
1 :0,5=6,02· 10 23 : х ; х = 0,5· 6,02 • 10 23 =3,01 • 10 23 : х= 3,01· 10 23 атомов
Ответ. В 20 г кальция содержится 3,01-10 23 атомов.
Р е ш е н и е. Определяем молярную массу воды
2) Находим количество вещества воды:
v=m/M =36/18=2; v(Н 2 О)=2 моль
3) Определяем число молекул воды:
1 моль Н 2 О содержит 6,02 ∙ 10 23 молекул
1:2=6,02 ·10 23 : х ; х=2 · 6,02 ·10 23 = 1,204·10 24 ;
х= 1,204·10 24 молекул Н 2 O.
Ответ. В воде массой 36 г содержится 1,204 ·10 24 молекул.
IV. Расчеты, связанные с использованием плотностей, относительных плотностей и молярного объема газов.
1. Нахождение плотности и относительной плотности газа по химической формуле данного газа.
Задача. Вычислите плотность и относительные плотности оксида углерода (IV) по водороду, метану и воздуху (плотность обозначается буквой р, а относительная плотность—буквой D) (I, с. 139).
Решение. 1) Вычисляем молярные массы газов:
M(C0 2 )= 44 г/моль; M(H 2 ) =2 г/моль;
М(СН 4 )= 16 г/моль; M возд =29 г/моль
2) Вычисляем плотности оксида углерода (IV):
р = 44/22,4 =1,96; р(С0 2 )=1,96 г/л;
D(CH 4 ) =44/16=2,75; D ( Н 2 ) = 44/2 =22;
Ответ. р(С0 2 )=1,96 г/л (масса 1 л при н. у.); D (Н 2 ) = 22;
D(CH 4 )=2,75; D возд = 1,5.
Такого вида расчеты широко применяются на практике, так как часто требуется определить, тяжелее или легче данный газ по отношению к воздуху.
2. Вычисление объема определенной массы газообразного вещества
Задача. Какой объем занимают 48 г кислорода?
Решение. 1) Вычисляем молярную массу кислорода:
2) Находим, какой объем занимают 48 г кислорода:
32 г О 2 занимают объем 22,4 л
32:48=22,4:х; х =
Ответ. Кислород массой 48 г занимает объем 33,6 л.
1) Вычисляем молярную массу кислорода:
2) Находим количество вещества, которому соответствует 48 г кислорода:
v=

3) Рассчитываем объем, который занимают 1,5 моль кислорода (н. у.):
v (0 2 )= 1,5 ·22,4 =33,6 л
Ответ. Кислород массой 48 г занимает объем 33,6 л.
3. Вычисление массы газообразного вещества, занимающего определенный объем
(При расчетах необходимо следить за тем, чтобы единицы измерения разных величин были пропорциональными. Так, если масса газообразного вещества выражена в килограммах, то объем следует выражать в кубических метрах.)
Решение. 1) Вычисляем молярные массы метана и оксида углерода (II):
M(CH 4 )=16 г/моль; M(СО)=28 г/моль
2) Определяем массу 5,6 м 3 метана:
масса 22,4 м 3 СН 4 составляет 16 кг
22,4 :5,6= 16 :х 1 ; х 1 = 
3) Определяем массу 2,24 м оксида углерода (II):
масса 22,4 м 3 СО составляет 28 кг
22,4: 22,4=28 :х 2 ; х 2 = 
4) Находим общую массу газовой смеси:
Отпет. Общая масса газовой смеси 6,8 кг.
4. Вычисление массы вещества по уравнениям химических реакций, в которых участвуют или образуются газы.
Задача. Какой объем кислорода и воздуха потребуется, чтобы сжечь 224 м 3 оксида углерода (II), если содержание в нем негорючих примесей в объемных долях равно 0,25 (или 25%)?
Решение. 1) Вычисляем, сколько чистого оксида углерода (II) содержится в смеси:
100 м 3 смеси содержат 75 м 3 СО
224 м 3 смеси » х 1
100:224=75:х 1 ; х 1 = 
Вычисление можно провести и так: v (СО)=224м 3 ·0,75=168 м 3 СО.
2) Определяем, какой объем кислорода потребуется, чтобы сжечь 168 м 3 оксида углерода (II):
44,8:168 = 22,4 😡 2 ; x 2 = 

V 0 (O 2 )=V(O 2 ) 
3) Находим объем воздуха, необходимый для реакции:
100 м 3 воздуха содержат 21 м 3 кислорода
100:х 3 =21:84; х 3 =
Ответ. Потребуется 84 м 3 О 2 или 400 м 3 воздуха.
1. Вычисление массы растворенного вещества и растворителя, если известны массовая доля растворенного вещества и масса раствора.
Задача 1. Вычислите массу хлорида натрия и воды, необходимых для приготовления 500 г раствора, в котором массовая доля хлорида натрия равна 0,05 (или 5%).
Решение. 1) Находим, какая масса хлорида натрия необходима для приготовления указанного раствора. При решении можно использовать два подхода.
1 массовая доля соответствует 500 г
1 : 0,05 =500 : х; х=
Рассуждать можно и так:
а) 100 г раствора содержат 5 г NaCI 500 г
100:500=5:х; х=
б) m (NaCI) = 500 г · 0,05 = 25 г
2) Вычисляем, какая масса воды потребуется:
m (Н 2 О) = 500 г — 25 г = 475 г
Ответ. Потребуется 25 г NaCI и 475 г воды.
Задача 2. Какой объем хлороводорода (н. у.) и воды потребуется, чтобы приготовить 1 л раствора (р =1,05 г/см 3 ), в котором массовая доля хлороводорода равна 0,1 (или 10%)?
Решение. 1) Вычисляем массу 1 л раствора, в котором массовая доля хлороводорода равна 0,1 (или 10%).
Вычисление можно провести по известной вам формуле из курса физики:
m раствора = 1000 ·1,05=1050; m раствора = 1050 г
2) Находим массу хлороводорода, содержащегося в 1050 г раствора соляной кислоты указанной концентрации:
1 мае. д. соответствует 1050 г
1:0,1=1050:х 1 ; х 1 =
или m (НС1) = 1050 · 0,1 = 105 г; m = 105 г
3) Вычисляем, какой объем (н. у.) занимают 105 г хлороводорода:
36,5 г НC1 занимают объем 22,4 л
36,5 : 105 = 22,4 : x 2 ; x 2 =
4) Находим, сколько потребуется воды для приготовления раствора:
m (Н 2 0)=1050 г — 105 г = 945 г
Ответ. Потребуется 64,44 л НС1 и 945 мл воды.
2. Вычисления, связанные с разбавлением растворов
Задача 1. Какой объем раствора (р =1,80 г/см 3 ), в котором массовая доля H 2 S0 4 равна 0,88, потребуется, чтобы приготовить 1 л раствора, в котором массовая доля H 2 S0 4 будет равна 0,1 (р =1,069 г/см 3 )?
Решение. 1) Вычисляем массу 1 л раствора, в котором массовая доля H 2 S0 4 равна 0,1 (или 10%):
m раствора = 1000 · 1,069 = 1069; m раствора = 1069 г
2) Определяем массу чистой серной кислоты, которая потребуется:
100 г приготовляемого раствора содержат 10 г H 2 S0 4
100 : 1069 = 10 : х 1 ; х 1 = 
или m (H 2 S0 4 ) = 1069 · 0,1 = 106,9, m (H 2 S0 4 ) = 106,9 г
3) Находим, сколько потребуется раствора, д котором массовая доля серной кислоты равна 0,88 (или 88%):
100 г раствора содержат 88 г H 2 S0 4
х 2 » » 106,9 г H 2 S0 4
100 : х 2 = 88 : 106,9; х 2 =
4) Вычисляем, какой объем занимают 121,5 г раствора, в котором массовая доля H 2 S0 4 равна 0,88 (или 88%):
V раствора =121,5/1,80 = 67,5; V раствора =67,5 мл
Ответ. Потребуется 67,5 мл раствора, в котором массовая доля серной кислоты составляет 0,88.
Задача 2. Какой объем воды потребуется для разбавления 200 мл раствора (р =1,4 г/см 3 ), в котором массовая доля НNОз составляет 0,68 (или 68%), чтобы получить раствор, в котором массовая доля НNОз равна 0,1 (или 10%)?
Решение. 1) Находим массу 200 мл разбавляемого раствора азотной кислоты:
m раствора 200 · 1,4 = 280; m раствора =280 г
2) Вычисляем массу чистой азотной кислоты, содержащейся в 280 г разбавляемого раствора:
100 г раствора содержат 68 г НNОз
или m (НМОз) =280 · 0,68 = 190,4 г
3) Вычисляем, какую массу 10%-ного раствора можно приготовить из 190,4 г чистой азотной кислоты:
100 г раствора содержат 10 г НМОз
100:x 2 =10:190,4; x 2 =
или m(НМОз)= 190,4:0,1 =1904 г
4) Находим объем воды, который необходимо прилить для приготовления раствора заданной концентрации:
Патриархом в период правления Василия Шуйского был избран а)митрополит Филаретб)митрополит Макарийв)митрополит Филиппг)митрополит Гермоген
Назовите причины возникновения мегаполисов в США.
Некоторое число разделили в отношении 8:9, при этом разность большей и меньшей частей получилась равной 6. какое число разделили?А)72 Б)54 В)102 Г)98