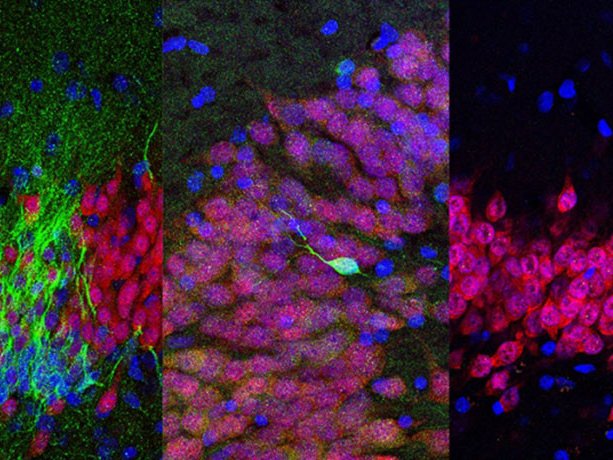
в какой области мозга происходит рождение новых нейронов во взрослом мозге
Производит ли взрослый мозг новые нейроны?
Еще одно поколение назад считалось, что, когда человек достигает зрелого возраста, мозг перестает производить новые нервные клетки. 20 лет назад ученые обнаружили признаки того, что взрослый мозг может восполнять запас нейронов. Последствия этого открытия были огромными: этот процесс мог бы помочь бороться с такими расстройствами, как депрессия и болезнь Альцгеймера.
В этом году, однако, появилось несколько противоречивых свидетельств, и снова разгорелись жаркие дебаты. Поэтому сегодня мы до сих пор не знаем, производит ли взрослый мозг новые нервные клетки.
7 марта в журнале Nature появился скандальный материал. Вопреки нескольким знаковым открытиям, которые убедили научное сообщество в том, что взрослый мозг может создавать новые нервные клетки, исследователи описали полное отсутствие деления нервных клеток или нейронов во взрослой ткани мозга после смерти. Месяц спустя другая исследовательская группа описала множество новых нейронов в посмертном мозге в статье от 5 апреля в Cell Stem Cell. В июле третья научная группа снова не нашла новых нейронов в мозге после смерти (статья в журнале Cerebral Cortex). Тогда еще больше нейробиологов вступили в борьбу с собственными комментариями и перспективными статьями.
Новые методы количественного определения активных генов в отдельных клетках могут в конечном итоге обеспечить более точный способ идентификации новых нейронов. Могут помочь другие экспериментальные методы, такие как выращенные в лаборатории органоиды мозга или сложные сканирования мозга. Если бы исследователи могли определить некие маркеры нейрогенеза, которые можно было бы обнаружить по анализу крови или спинномозговой жидкости, то этот процесс мог бы быть изучен на живых людях.
Между тем, некоторые исследователи забегают вперед и хотят выяснить, как можно использовать рост нейронов для улучшения здоровья. Уже нет сомнений в том, что взрослые мыши создают новые нейроны. 7 сентября в журнале Science ученые сообщили, что в сочетании с соединением под названием BDNF, стимулирующим нейрогенез у мышей с признаками болезни Альцгеймера, улучшаются их умственные способности.
Если люди, подобно мышам, могут после совершеннолетия производить новые нейроны, то, возможно, это поможет предотвратить болезнь Альцгеймера и другие нейродегенеративные заболевания. Но, как показали новости этого года, это большое «если».
PsyAndNeuro.ru
Нейрогенез и ростральный миграционный тракт
Нейрогенез – это процесс образования нейронов. Функционирует он примерно также, как и образование кровяных тел: есть пул клеток предшественников нейронов, происходит их пролиферация, далее происходит их развитие и дифференцировка, а кончается все это образованием нового нейрона, интегрированного в нейрональную сеть. Понятное дело, что этот процесс наиболее активен во время пренатального развития, но все же некоторая его активность наблюдается и у взрослых. В данной статье речь пойдет именно про нейрогенез у взрослых, эмбрионального же развития касаться в основном не будем.
Нейрогенез у взрослых организмов был обнаружен сравнительно недавно (только в последние десятилетия), в основном благодаря развитию иммуногистохимических методов и конфокальной микроскопии. Сначала выявили постнатальный нейрогенез у птиц, затем у млекопитающих и только потом уже у человека [1].
Методы исследования нейрогенеза
Иммуногистохимическое исследование – метод микроскопического исследования тканей, обеспечивающий наиболее специфическое выявление в них искомых веществ и основанный на обработке срезов маркированными специфическими антителами к выявляемому веществу, которое в данной ситуации служит антигеном. Метод бывает прямой и непрямой. Прямой основан на реакции специфического связывания марированных антител непосредственно с антигеном. При непрямом сначала с антигеном связываются антитела, а уже потом с антителами марикрованные антитела.
Конфокальная микроскопия – разновидность световой оптической микроскопии, обладающей значительным контрастом и пространственным разрешением по сравнению с классической световой микроскопией. По сути, такой эффект достигается за счет контролируемого ограничения глубины фокуса оптической системы (Схема 1).
Схема 1
Но что же все искали в клетках, участвующих в нейрогенезе? А искать нужно белок даблкортин (DCX). Этот белок ассоциирован с микротрубочками и экспрессируется практически всеми незрелыми нейронами. Нейрональные клетки-предшественники начинают производить DCX вскоре после входа в клеточный цикл с затуханием экспрессии через 2-3 недели, ко времени окончательного превращения в развитые нейроны.
Имеется также еще один способ изучения нейрогенеза. Заключается он в использовании бромдезоксиуридина (BrdU). Он является синтетическим нуклеозидом, аналогом тимидина, используемым для выявления пролиферирующих клеток в живых тканях, а также для изучения репликации ДНК. Бромдезоксиуридин способен заменять тимидин в процессе репликации ДНК, встраиваясь в новую ДНК. Иммуногистохимическое окрашивание с антителами к бромдезоксиуридину позволяют обнаружить включённый модифицированный нуклеозид, тем самым выявляя пролиферирующие клетки [2,3,4].
Но где же находятся эти пулы стволовых клеток? Есть два основных места: субгранулярная зона зубчатой извилины гиппокампа и субвентрикулярная зона.
Субгранулярная зона зубчатой извилины гиппокампа
Субгранулярная зона зубчатой извилины гиппокампа – область мозга, расположенная между слоем гранулярных клеток и хилусом зубчатой извилины гиппокампа. В субгранулярной зоне происходит постнатальный («взрослый») нейрогенез — образование новых нейронов из полипотентных клеток-предшественников [5].
Субвентрикулярная зона
Субвентрикулярная зона – это область первичной миграции нейро- и глиобластов из вентрикулярной герминативной зоны. Субвентрикулярная зона простирается вдоль большей части латерально расположенной внутренней поверхности боковых желудочков мозга. Наряду с субгранулярнойзонойзубчатой извилины гиппокампа, субвентрикулярная зона является источником новых нейронов на протяжении всей взрослой жизни организма (Рис. 1).
Рис. 1
Выделяется 4 типа клеток субвентрикулярной зоны:
1) Реснитчатые эпендимоциты типа E
2) Пролиферирующие нейробласты типа А
3) Медленно пролиферирующие клетки типа B
4)Активно пролиферирующие клетки типа С
Реснитчатые эпендимоциты типа Е обращены в полость желудочка и стимулируют циркуляцию цереброспинальной жидкости. Пролиферирующие нейробласты типа А объединяются в цепочки и мигрируют по направлению в обонятельной луковице. Медленно пролиферирующие клетки типа B образуют глиальные трубки, внутри которых происходит миграция нейробластов типа А. Активно пролифирующие клетки типа С образуют скопления между цепочками клеток А [6].
Ростральный миграционный тракт
Ростральный миграционный тракт – это путь по которому нейробласты мигрируют из субвентрикулярной зоны в обонятельную луковицу. Зарождение новых клеток в субвентрикулярной зоне и их миграция по ростральному миграционному потоку происходит на всем протяжении взрослой жизни организма. Группы нейробластов мигрируют цепочками, продвигаясь по глиальным трубкам, образованным астроцитарными клетками и их отростками.Лишь достигнув середины обонятельной луковицы, цепочки новорожденных нейронов распадаются и клетки начинают радиальную миграцию. Так они достигают верхних клеточных слоев, где происходит их окончательная дифференциация. Рассеивание цепочек нейробластов инициируется протеинами рилином и тенасцином, а сам процесс радиальной миграции зависит от наличия тенасцина-R. Большое количество новых нейронов отмирает вскоре после окончания миграции. В долгосрочной перспективе, около 50 % оставшихся клеток также отмирают, даже после успешного приживления в гранулярном и перигломерулярном слоях и установления связей с другими клетками [7].
Функциональное значение нейрогенеза – это все еще дискутабельный вопрос, вдруг он является просто сбоем механизма эмбрионального развития? Но все же считается (и волне обосновано), что нейрогенез способствует пластичности биологических нейронных сетей. Например, молодые гранулярные клетки в зубчатой извилине имеют более низкий порог долговременной потенциации, чем старые клетки [8].
Регуляция нейрогенеза
Но что же регулирует процесс нейрогенеза у взрослых? Почему у нас нет бесконечно делящихся нейронов и наш мозг не разрастается до того, что перекрывает все пути циркуляции ликвора? Факторы ответственные за этот процесс весьма многочислены, вот лишь некоторые из них: гормоны, факторы роста, различные нейротрансмиттеры, цитокины, электрофизиологическая активность. Ниже мы рассмотрим эти процессы чуть болеее подробно.
С помощью различных манипуляций с дофамином учёным удалось влиять на интенсивность нейрогенеза. Что касается участия серотонина в нейрогенезе взрослого мозга, установлено его потенцирующее влияние на образование и трансформацию нейробластов в субвентрикулярной зоне гиппокампа. Активация 5-НТ2С рецепторов в регионе сосудистого сплетения вдвое увеличивает пролиферацию прогениторов в субвентрикулярной зоне, тогда как блокада 5-НТ2А рецепторов ведет к аналогичному снижению числа пролиферирующих клеток в субгранулярной зоне гиппокампа. Более того, систематическое введение ингибиторов синтазы оксида азота увеличивает пролиферацию в субвентрикулярной зоне, но не в зубчатой извилине гиппокампа. ГАМК также усиливает нейрогенез, причём некоторые из его эффектов реализуются через белок CREB. Действие же глутама двояко (он может как снижать, так и повышать пролиферацию и дифференцировку) и зависит от рецептора, с которым он связывается. Наконец можно обрадовать и тех, кто ищет паралели с болезнью Альцгеймера – ацетилхолин. Нарушение холинэергической иннервации снижает число образующихся нейронов, а усиление – наоборот.
РАСАР (Pituitary Adenylate Cyclase Activating Polypeptide – «полипептид, активирующий аденилатциклазу гипофиза»). Данный пептид реализует свои эффекты через РАС1R рецептор. Стволовые клетки субвентрикулярной зоны при внесении агониста рецептора РАС1R пролиферировались in vitro, тогда как селективный антагонист РАСАР тормозил этот процесс.
Также не следует забывать о нейротрофинах. Нейротрофины – семейство крупных полипептидов, которые регулируют выживание, развитие и согласованную функцию нейронов. Секретируемые нейрональными и васкулярными клетками нейротрофины выполняют сигнальную миссию в большом спектре физиологических процессов. Эффекты нейротрофинов осуществляются при их взаимодействии с тирозинкиназными рецепторами. Принципиально и то, что после соединения рецептора с лигандом запускается каскад сигнальных реакций, специфичных для этого контакта. Нейротрофины активируют тирозинкиназные рецепторы семейства Trk – trk-A, trk-B, trk-C.
Поскольку нейральные стволовые клетки способны дифференцироваться в различные типы – нейроны, олигодендроциты и глиальные клетки, вектор их трансформации, по-видимому, определяется специфическими путями сигнального контроля. Регуляция таких каскадных реакций зависит от ростовых и нейротрофических факторов. Выделяют основные соединения, которые играют роль в трансформации НСК: (1) нейротрофический фактор мозга (BDNF); (2) тромбоцитарный и эпидермальный факторы роста (PDGF/EGF); (3) трансформирующий ростовой фактор (TGF-beta1) и костный морфогенный белок (BMP); (4) группа, включающая интерлейкин-6 (IL-6), ингибирующий фактор лейкемии (LIF), реснитчатый нейротрофический фактор (CNTF). Эти вещества рассматриваются как лиганды, которые после соединения с рецептором индуцируют специфические сигнальные процессы. В результате экспрессируется активность внутриклеточных мессенджеров и далее – селективная активация транскрипторных факторов, в соответствии с функциональным назначением сигнала.
Реализация любых эффектов нейротрофинов осуществляется при участии тирозинкиназных рецепторов с последующим включением трансдукторных реакций. Активация тирозинкиназных рецепторов стимулирует многовариантный каскад реакций, ведущих к образованию продуктов с последовательной экспрессией (фосфорилированием) новых белков. Результатом этих процессов оказывается рилизинг Са++ в цитоплазме нейрона, торможение апоптоза и стимулирование выживания клеток. Далее, результатом трансдукторных реакций является перенос сигнала в ядро нейрона и стимуляция транскрипторных процессов, реализуемых на уровне ДНК, осуществляющих синтез продуктов, необходимых для функции клеток.
Активация тирозинкиназных рецепторов ведет к инициации молекулярных сигналов, нацеленных на экспрессию генов, кодирующих соответствующие функциональные белки. Активация TrKs ведет к активации PLC-γ (фосфолипаза С-γ), PI3K (фосфатидилинозитол-3- киназа) и PIP2 (фосфатинозитол 3,5–бифосфат). Путь сигнальной регуляции, указанный в правой части рисунка, предусматривает после активации PLC-γ образование DAG (диацилглицерол) и IP3 (инозитолтрифосфат). Молекулы, рассматриваемые как вторичные посредники, стимулируют активность РКС-δ (протеинкиназа-δ) и увеличение внутриклеточного Са2+; эти процессы являются ключевыми в активации кальмодулина (СаМ), образования и дифференцировки нейронов. Еще один путь включает активацию молекул семейства Ras (небольшие G-белки гуанитидилтрифосфатазы), далее белки Raf-киназы, промотирующие, в свою очередь, фосфорилирование и активацию системы MAPK/ERK (MAPKs – митоген-активированные белки и ERK1/2 – внеклеточные сигнал-регулируемые киназы). Эти фосфорилированные белки транслоцируются далее в клеточное ядро, где они участвуют в активации транскрипторных факторов CREB, NF-kB, c-JIN (и др.), регулируя экспрессию генов, промотирующих формирование нейронов. Например, связывание нейротрофина NGF с рецептором TrKA в терминалях аксонов стимулирует рост последних как результат «прозванивания» цепочки ERK1/2- CREB. На культуре симпатических нейронов было установлено, что торможение сигнального пути Ras-PI3K-Akt снижает выживание трансформирующихся клеток после апоптоза. MAPK-ERK1/2 участвуют в нейрогенезе, контролируя селекцию клеток путем индукции генов выживания и торможением проапоптических белков. Ras также подавляет апоптоз через экспрессию PI3K-Akt, которые блокируют проапоптические белки.
Подготовил: Коровин А.С.
Источники:
1 – Ming G. L., Song H. (2011). «Adult neurogenesis in the mammalian brain: significant answers and significant questions.». Neuron 70 (4): 687—702. DOI:10.1016/j.neuron.2011.05.001.
2 – Wilson G. D. et al. Measurement of cell kinetics in human tumours in vivo using bromodeoxyuridine incorporation and flow cytometry //British journal of cancer. — 1988.
3 – Gratzner H. G. Monoclonal antibody to 5-bromo-and 5-iododeoxyuridine: a new reagent for detection of DNA replication //Science. — 1982
4 – Ikushima T., Wolff S. Sister chromatid exchanges induced by light flashes to 5-bromodeoxyuridine-and 5-iododeoxyuridine substituted Chinese hamster chromosomes //Experimental cell research.
5 – Oomen C. A., Girardi C. E., Cahyadi R., Verbeek E. C., Krugers H., Joëls M., Lucassen P. J. Opposite effects of early maternal deprivation on neurogenesis in male versus female rats. (англ.) // Public Library of Science ONE. — 2009. — Vol. 4, no. 1. — P. e3675. — DOI:10.1371/journal.pone.0003675.
6 – Abrous DN, Koehl M, Le Moal M. (2005) Adult neurogenesis: from precursors to network and physiology.
7 – Roy NS, Wang S, Jiang L, et al (March 2000).«[10.1038/73119 In vitro neurogenesis by progenitor cells isolated from the adult human hippocampus]». Nat. Med. 6 (3): 271–7. DOI:10.1038/73119.
8 – Lledo PM (2006). «Adult neurogenesis and functional plasticity in neuronal circuits.». NatRevNeurosci 7 (3): 179-93.
В какой области мозга происходит рождение новых нейронов во взрослом мозге
ФГБУ «НМИЦ им. В.А. Алмазова» Минздрава России, Санкт-Петербург, Россия
ФГБУ «Санкт-Петербургский научно-исследовательский институт фтизиопульмонологии»; Медицинский факультет Санкт-Петербургского университета
Морфологические аспекты нейрогенеза в головном мозге взрослого человека
Журнал: Архив патологии. 2018;80(6): 55-61
Перминова А. А., Цинзерлинг В. А. Морфологические аспекты нейрогенеза в головном мозге взрослого человека. Архив патологии. 2018;80(6):55-61.
Perminova A A, Tsinzerling V A. Neurogenesis in the adult human brain: morphological aspects. Arkhiv Patologii. 2018;80(6):55-61.
https://doi.org/10.17116/patol20188006155
ФГБУ «НМИЦ им. В.А. Алмазова» Минздрава России, Санкт-Петербург, Россия
Широкая распространенность заболеваний, приводящих к инвалидности вследствие поражений головного мозга, делает исключительно актуальным изучение различных механизмов нейрореабилитации, среди которых в последнее время важную роль стали отводить нейрогенезу. За последние 20 лет получено большое количество данных о нейрогенезе в головном мозге у взрослых животных. Несмотря на то что развитие головного мозга человека в пренатальном периоде изучено достаточно хорошо, количество работ, посвященных процессу образования новых нейронов в головном мозге взрослого человека, не столь велико. Настоящий обзор, посвященный исследованиям нейрогенеза в головном мозге взрослого человека, включает данные об изменениях нейрогенеза с возрастом при нейродегенеративных заболеваниях, инсультах, эпилепсии, различных аддикциях, травматических повреждениях, естественной и лекарственной регуляции. В заключение перечисляются вопросы, по которым в литературе достигнуто согласие или имеются противоречивые мнения, указываются неосвещенные аспекты проблемы.
ФГБУ «НМИЦ им. В.А. Алмазова» Минздрава России, Санкт-Петербург, Россия
ФГБУ «Санкт-Петербургский научно-исследовательский институт фтизиопульмонологии»; Медицинский факультет Санкт-Петербургского университета
Широкая распространенность заболеваний, приводящих к инвалидности вследствие поражений головного мозга, делает исключительно актуальным изучение различных механизмов нейрореабилитации, среди которых в последнее время важную роль стали отводить нейрогенезу. Нейрогенез — процесс, приводящий к образованию функционирующих нейронов из нейральных стволовых клеток. За последние 20 лет получено большое количество данных о нейрогенезе в головном мозге у взрослых животных. Несмотря на то что развитие головного мозга человека в пренатальном периоде изучено достаточно хорошо, количество работ, посвященных процессу образования новых нейронов в головном мозге взрослого человека, не столь велико. Среди прочего это связано со сложностью получения тканей головного мозга от живого человека, в том числе от пациентов, у которых заболевание не закончилось летальным исходом. Кроме того, в настоящее время недостаточно изучено, насколько полноценны в функциональном отношении вновь образованные нейроны и их связи. Настоящий обзор посвящен исследованиям нейрогенеза в головном мозге взрослого человека.
Общие сведения
В 1894 г. S. Ramon y Cajal описал фенотип клеток ЦНС и определил структуры мозга как статичные и не способные к образованию новых клеток [1], а уже в 1912 г. были впервые продемонстрированы пролиферирующие клетки в стенке латеральных желудочков головного мозга у крыс [2]. Почти за 100 лет исследования получено много новых данных. «Традиционными» нейрогенными зонами считаются субвентрикулярная и субгранулярная зона зубчатой извилины гиппокампа [3, 4]. Однако большинство исследований было проведено на животных. Работ, выполненных на материале, полученном от человека, на сегодняшний день очень немного.
В 1996 г. in vitro впервые показана способность нейросенсорных обонятельных клеток взрослого человека к пролиферации и дифференцировке. Обонятельный эпителий был получен как из аутопсийного (8—25 ч с момента смерти), так и из биопсийного материала (максимальный возраст пациента 72 года). Под воздействием bFGF (basic fibroblast growth factor) биполярные клетки дифференцировались, становясь иммунопозитивными по отношению к некоторым нейрональным (но не глиальным) белкам. С помощью радиоавтографии с 3H-тимидином доказано, что эти нейроны появились in vitro [5]. P. Eriksson и соавт. [6] продемонстрировали, что в зубчатой извилине гиппокампа взрослого человека из делящихся клеток-предшественников образуются новые нейроны. Деление документировалось с помощью бромдезоксиуридина (BrdU), а их принадлежность к нейронам — по окрашиванию на NeuN (neuronal nuclei) и NSE (neuron specific enolase), которые коэкспрессировались с бромдезоксиуридином. При этом среди BrdU±клеток встречались как NSE+ и NeuN+ (молодые нейроны, около 22% клеток), так и GFAP+ (glial fibrillary acidic protein) клетки (молодая астроглия, около 18% клеток). Перекрестную реакцию на нейрональные и глиальные маркеры не выявляли, однако во всех наблюдениях были BrdU±клетки, не экспрессировавшие ни глиальные, ни нейрональные маркеры и морфологически похожие на недифференцированные клетки. Помимо зубчатой извилины, авторы изучили субвентрикулярную зону вблизи хвостатого ядра, в которой обнаружили BrdU±клетки, которые не коэкспрессировали ни GFAP, ни NeuN, что позволило предположить, что в этой зоне находятся низкодифференцированные предшественники. Исследование проводили на аутопсийном материале, полученном от 5 пациентов, страдавших плоскоклеточным раком корня языка, гортани или глотки без метастазов в головной мозг. Всем пациентам BrdU вводили внутривенно (пациенты в этот момент не получали противоопухолевую терапию).
В исследовании K. Spalding и соавт. [7] количество вновь образованных клеток в гиппокампе человека оценивали путем измерения 14 C в ДНК пролиферирующих клеток. Часть нейронов гиппокампа появляется постнатально, однако «обороту» подлежит 35% нейронов гиппокампа человека, в то время как у мышей этот показатель составляет 10%. В гиппокампе взрослого человека ежедневно образуется 700 новых нейронов, что приводит к замене 1,75%. Количество вновь образованных нейронов несколько снижается с возрастом. Инкорпорация 14 C в организм человека происходила путем потребления в пищу растений, содержащих 14 C как последствие ядерных испытаний. Исследование проводили на аутопсийном материале, полученном от пациентов 19—92 лет. Из ткани гиппокампа изолировали ядра клеток, которые затем инкубировали с антителами к NeuN. Далее ядра нейронов и клеток, не являвшихся нейронами, разделяли методом проточной цитометрии.
В дальнейшем аналогичным методом установлено, что маркеры нейробластов DCX (даблкортин) и PSA-NCAM (Polysialylated neural cell adhesion molecule) выявляются не только в субвентрикулярной зоне, но и в стриатуме. Исследование проводили на аутопсийном материале. Методом центрифугирования из стриатума изолировали ядра, затем с помощью антител к NeuN и SOX10 (SRY-related HMG-box) и проточной цитометрии идентифицированные как нейрональные и глиальные [8]. Следует заметить, что у животных нейрогенные процессы в стриатуме замечены относительно давно [9].
Еще одной нейрогенной зоной у животных являются обонятельные луковицы (как часть рострального миграционного потока) [10]. У человека в этой зоне пролиферирующие клетки-предшественники либо незрелые нейроны пока не обнаружены, однако в 2014 г. с помощью функциональной геномики была доказана возможность нейрогенеза в обонятельной луковице взрослого человека. Пятая часть экспрессировавшихся в обонятельной луковице генов служит для функционирования и развития нервной системы, половина из которых связана с аксоногенезом. Другие экспрессировавшиеся гены связаны с передачей сигнала или ответом на химические стимулы. Исследование проводили на двух обонятельных луковицах от 1 пациента (операционный материал) [11].
Нейрогенез и возраст
В опытах на животных показано, что пролиферация в нейрогенных зонах снижается с возрастом [12, 13]. Работ, посвященных тому, как меняется процесс образования новых нейронов в головном мозге человека в зависимости от возраста, крайне мало. Среди них исследование N. Roy и соавт. [14], которые in vitro изучали нейрогенез из клеток-предшественников, полученных из зубчатой извилины гиппокампа взрослого человека (операционный материал при височной лобэктомии). Была произведена трансфекция выделенных клеток плазмидной ДНК, несущей ген hGFP (humanized green fluorescent protein). Плазмидная ДНК была помещена перед генами, кодирующими нестин (нейроэпителиальный белок) или T-α1-тубулин (ранний нейрональный белок). Флюоресцирующие клетки отсортированы с помощью проточной цитометрии. Нестин+ и T-α1-тубулин+ клетки помещены отдельно. Авторы показали, что и те и другие клетки in vitro превратились в нейроны (экспрессия βIII-тубулина либо МАР-2 (microtubule-associated protein-2)), причем многие из них инкорпорировали BrdU+, что свидетельствует о появлении этих клеток в процессе культивирования in vitro. Исследование проводили на материале, полученном от 8 пациентов мужского пола 5—63 лет, при этом авторы не указывают на какие-либо различия в зависимости от возраста.
R. Knoth и соавт. [15] исследовали изменения нейрогенеза у человека и животных с возрастом. Установлено, что в гиппокампе взрослого человека иммуногистохимические (ИГХ) характеристики нейрогенеза похожи на таковые у грызунов. С возрастом у человека общее количество DCX±клеток в гиппокампе экспоненциально уменьшается. В отличие от животных у человека не удалось обнаружить морфологически столь четкой субгранулярной зоны, как у грызунов. При этом в раннем постнатальном периоде вместе с DCX в клетках выявляется еще 14 маркеров (маркеры пролиферации — PCNA (proliferating cell nuclear antigen), Ki-67, Mcm2 (Saccharomyces cereviseae minichromosome maintenance 2 homolog); маркеры клеток предшественников — нестин и Sox2; маркеры созревания — PSA-NCAM, кальретинин, Tuc4, βIII-тубулин, NeuN, Map2, GAD67; маркеры клеточных линий — NeuroD1, Prox1). К 40–50 годам с DCX перестают коэкспрессироваться Tuc4, MAP2, NeuroD1 и Ki-67. У лиц старше 75 лет вместе с DCX в клетках обнаруживаются уже только PCNA, Sox2, нестин, βIII-тубулин (он же Tuj1), кальретинин, NeuN, GAD67, Prox1. Исследование проводили на архивном аутопсийном материале от пациентов обоих полов в возрасте от 1 дня до 100 лет с позитивным и негативным контролем и с определением на индуцируемые гипоксией белки. Для исследования использованы вестерн-блоттинг, ИГХ-метод и гибридизация in situ.
В 2016 г. подробно изучен нейрогенез в субвентрикулярной и субгранулярной зонах головного мозга человека в зависимости от возраста. Установлено, что в течение первых лет жизни в субвентрикулярной и субгранулярной зонах происходит быстрое уменьшение количества пролиферирующих клеток: в субвентрикулярной зоне количество делящихся клеток становится равным количеству пролиферирующих клеток в окружающей паренхиме к 4 годам жизни, а в субгранулярной — к 1 году. У детей раннего возраста пролиферирующие клетки коэкспрессируют EGFR (маркер нейральных предшественников), Olig2 (маркер олигодендроглии), DCX и Tuj1 (маркеры незрелых клеток нейрональной дифференцировки). Однако после 3 лет клетки микроглии (Iba1+) были единственными пролиферирующими клетками в субвентрикулярной и субгранулярной зонах и в окружающей паренхиме. Если окрашивание на Ki-67 и PCNA в субвентрикулярной зоне располагалось в одних и тех же частях клеток во всех возрастных группах, то окрашивание на DCX в возрасте до 4 лет выявлялось перинуклеарно и в дендритах, в 7—16 лет преимущественно перинуклеарно, а после 16 лет не выявлялось вовсе. Исследование [16] проводили на аутопсийном материале от 23 пациентов (возраст 0,2—59 лет) с использованием ИГХ-метода и иммунофлюоресценции (ИФ).
В 2018 г. в журнале Nature опубликовано большое исследование, в котором авторы [17] показали, что нейрогенез в гиппокампе человека быстро снижается в постнатальном периоде и практически прекращается во взрослом возрасте.
Нейрогенез в условиях ишемического и геморрагического инсульта
В исследованиях на животных многократно показано, что нейрогенез в головном мозге (в частности, в субвентрикулярной и субгранулярной зонах) усиливается при ишемическом повреждении [18]. Хотя при повреждении в субвентрикулярной и субгранулярной зонах активируются пролиферативные процессы, часть из вновь образованных нейронов гибнет в результате апоптоза [19]. Усиление пролиферации при повреждении приводит к появлению большого количества незрелых астроцитов и активированной микроглии (но не нейронов) в субвентрикулярной зоне у взрослых крыс [20].
В 2006 г. впервые показано, что в головном мозге взрослого человека при инсульте вокруг очага некроза находятся клетки, экспрессирующие маркеры вновь образованных нейронов, причем эти клетки располагались преимущественно вблизи кровеносных сосудов. Исследование проводили на биопсийном материале от 6 пациентов, в качестве контроля использовали аутопсийный материал. При проведении ИФ-исследования применяли маркеры пролиферирующих клеток (Ki-67, PCNA, MCM2) и маркеры нейрональной линии дифференцировки (даблокортин — DCX, TUC4 (TOADUlipCRMP family protein 4), βIII-тубулин, ENCAM (embryonic nerve cell adhesion molecule)). В головном мозге пациентов из контрольной группы были единичные Ki-67±клетки и отсутствовали клетки с фенотипом Ki-67+/DCX+. В головном мозге пациентов с инсультом возрастало количество Ki-67±клеток и появлялись Ki-67+/DCX±клетки. Во многих Ki-67±клетках коэкспрессировались PCNA и MCM2 (маркеры недавней пролиферации), а также DCX, TUC4, βIII-тубулин (маркеры вновь образованных нейронов). Интересно заметить, что некоторые Ki-67+/DCX±клетки имели морфологию мигрирующих клеток (вытянутая цитоплазма, «лидирующий» край (leading edge) и «отстающее» ядро). В зубчатой извилине гиппокампа новые нейроны располагались вблизи сосудов (васкулярные ниши) [21].
Еще одно важное исследование [22] проведено на аутопсийном материале от 84-летней пациентки, которая за неделю до смерти перенесла инсульт в области правой нижней лобной извилины. При ИГХ-исследовании использовали антитела к нестину, Musashi, PSA-NCAM, von Willebrand factor, VEGF (vascular endothelial growth factor), SOX2 и (SSEA)-4 (stage-specific embryonic antigen — для выявления недифференцированных эмбриональных стволовых клеток). Обнаружено, что в зоне инфаркта присутствуют нейральные стволовые клетки (Nestin+, SOX2+, (SSEA)-4+) и нейральные клетки-предшественники (Musashi+, PSA-NCAM+), при этом в симметричных областях головного мозга таких клеток не было. У пациентки выявлено увеличенное количество нейральных стволовых клеток в субвентрикулярной зоне по сравнению с контролем. В зоне инфаркта была также выражена сосудистая реакция: много VEGF±клеток (возможно, VEGF является хемоаттрактантом, привлекающим нейральные стволовые клетки в зону повреждения), выявлялся фактор Виллебранда (свидетельствует о неоангиогенезе).
J. Shen и соавт. [23] показали, что у пациентов с первичным внутримозговым кровоизлиянием в участках базальных ядер и теменной доли вблизи гематомы клетки экспрессировали βIII-тубулин (ранний маркер клеток нейрональной дифференцировки), нестин (промежуточный филамент, обнаруживаемый у нейроэпителиальных предшественников), DCX (белок, ассоциированный с мигрирующими и дифференцирующимися нейронами), Musashi1 (маркер нейральных клеток-предшественников, в том числе нейральных стволовых клеток), Tuc4 (ранний маркер клеток с нейрональной дифференцировкой). Большинство нестин±клеток коэкспрессировало GFAP, что говорит об их принадлежности к астроцитам, а большая часть DCX±клеток коэкспрессировала βIII-тубулин, Musashi1 и Tuc4, причем все эти клетки были GFAP-негативными, что говорит об их принадлежности к нейрональной линии дифференцировки. В этих же клетках колокализованы маркеры клеточной пролиферации (Ki67, MCM2, PCNA). Авторы пришли к выводу, что внутримозговое кровоизлияние активирует нейрогенез в мозге взрослого человека. Исследование с изучением коэкспрессии маркеров ИФ-методом проводили на операционном материале, полученном от 5 пациентов.
Нейрогенез при нейродегенеративных заболеваниях
При моделировании на животных болезней Альцгеймера, Паркинсона и Гентингтона установлено, что при нейродегенеративных заболеваниях количество пролиферирующих клеток в головном мозге уменьшается по сравнению с контролем [24—26]. Данные, полученные у человека, не столь однозначны.
Установлено, что амилоидный β-пептид (самоаггрегирующийся нейротоксичный белок, который связывают с развитием болезни Альцгеймера) нарушает нейрогенез в субвентрикулярной зоне в культуре нейральных клеток-предшественников эмбриона человека (возраст 8—10 нед). Нейрогенез нарушается из-за подавления пролиферации и дифференцировки и активации апоптоза (вследствие нарушения регуляции обмена кальция в нейральных клетках-предшественниках) [27]. Однако чуть позднее выявлена возможность нейрогенеза в головном мозге взрослого человека в ответ на потерю нейронов, исследование проведено на аутопсийном материале от 9 пациентов с болезнью Гентингтона 41—74 лет. Проведено ИФ-окрашивание на белки PCNA (маркер S-фазы выявляет пролиферирующие клетки), GFAP и VIM (маркеры глиальных клеток) NeuN и βIII-тубулин (маркеры нейронов). В субэпендимальном слое, граничащем с хвостатым ядром, значительно увеличивалось количество PCNA±клеток в головном мозге пациентов с болезнью Гентингтона по сравнению с контролем. При этом в субэпендимальном слое были клетки как с фенотипом βIII-тубулин+/PCNA±нейроны (больше в глубоких слоях субэпендимального слоя), так и GFAP+/PCNA±глия (больше в поверхностных слоях субэпендимального слоя). Поскольку белок PCNA выявляется еще и в клетках в состоянии апоптоза или репарации, то было проведено ИГХ-окрашивание на TUNEL (Terminal deoxynucleotidyl transferase dUTP nick end labeling). В субэпендимальном слое обнаружено очень малое количество TUNEL±клеток, в то время как в хвостатом ядре — большое [28].
Выявлено, что при нейродегенеративных заболеваниях изменяется экспрессия активирующего транскрипцию фактора 2 (ATF2), который участвует как в нейрогенезе, так и в апоптозе нервных клеток. A. Pearson и соавт. [28] с помощью ИГХ-метода обнаружили ATF2 в головном мозге здорового человека в нейронах коры и в большом количестве в гранулярных клетках гиппокампа, стволе, пигментированных клетках substancia nigra и locus coeruleus, а также в молекулярном и гранулярном слоях мозжечка (авторами показано, что ATF2 не обнаруживается в глиальных клетках). В отличие от здорового головного мозга экспрессия ATF2 была снижена в гиппокампе при болезни Альцгеймера, в substancia nigra – при болезни Паркинсона и хвостатом ядре при болезни Гентингтона, причем при болезни Гентингтона в субэпендимальном слое экспрессия ATF2 увеличена по сравнению с контролем. Эти данные согласуются с тем, что при болезни Гентингтона в этой зоне увеличивается число пролиферирующих клеток. Исследование [29] проводили на аутопсийном материале от 48 пациентов (включая контрольную группу).
Еще одна работа посвящена выявлению изменения экспрессии ИГХ-маркеров в гиппокампе пациентов с деменцией с тельцами Леви. Изменения оценивали в субгранулярной, субвентрикулярной и эпендимальной зонах. Во всех зонах выявлено существенное уменьшение количества Musashi1±клеток, увеличение экспрессии PCNA в субвентрикулярной и субгранулярной зонах, а также увеличение количества экспрессирующих DCX-клеток в субвентрикулярной и эпендимальной зонах. Значимых различий при ИГХ-окрашивании на нестин, β-амилоид и GFAP между исследуемой и контрольными группами не обнаружено. Исследование [30] проводили на аутопсийном материале от 8 пациентов.
Нейрогенез и эпилепсия
При моделировании эпилепсии на грызунах показаны некоторые изменения в морфологии и связях вновь образованных нейронов (в частности, расширение дендритов, эктопическая миграция) [31]. Исследования влияния эпилепсии на нейрогенез у людей единичны.
Через 10 лет после описанного в 1997 г. нейрогенеза in vitro в эпилептогенном очаге височной доли неокортекса взрослого человека установлено, что в конечном мозге взрослого человека, страдающего эпилепсией, происходит нейрогенез, который отсутствует в контрольной группе [32]. Он начинался в субвентрикулярной зоне и продолжался в белом веществе, а затем и в неокортексе в патологических зонах, ассоциированных с эпилепсией. Авторы предположили, что этот нейрогенез может представлять собой либо часть патологического процесса, либо нарушенный механизм репарации. Исследование [33] проводили на операционном и аутопсийном материале от 47 пациентов, страдавших различными эпилептическими синдромами. В ходе исследования проводили ИГХ-окрашивание на Ki-67, PSA-NCAM, NeuN, MAP2, Tuj1, GFAP и CD68.
In vitro показано, что пролиферация клеток из зубчатой извилины гиппокампа взрослого человека с фармакорезистентной височной эпилепсией зависит от длительности заболевания. Исследование проводили на операционном материале от 16 пациентов, у которых заболевание наблюдали в течение нескольких лет. При культивировании клеток из зубчатой извилины гиппокампа пациентов, страдавших эпилепсией 10,20±1,93 года, образовывались нейросферы, а из клеток пациентов, страдавших эпилепсией 25,83±1,99 года, нейросферы не образовывались, причем процесс образования нейросфер не коррелировал с возрастом. При ИФ-исследовании нейросферы экспрессировали в большом количестве Mcm2, Musashi1, нестин, DCX, Tuj1, а также GFAP и cnpазу (маркер олигодендроглии) [34].
Нейрогенез при героиновой и алкогольной аддикциях
В многочисленных исследованиях на животных (в основном грызунах) показано, что хронические аддикции (никотиновая, алкогольная, опиатная, кокаиновая и др.) приводят к подавлению нейрогенеза [35].
На сегодняшний день известна лишь одна работа, в которой изучено влияние алкогольной зависимости на пролиферацию клеток в головном мозге человека. Показано, что у человека хронический алкоголизм не влияет на количество пролиферирующих клеток (PCNA+) в субвентрикулярной зоне и обонятельной луковице. Исследование проводили на аутопсийном материале от 15 пациентов [36].
Нейрогенез при травматическом повреждении
Существует довольно большое количество работ [38], в которых показано, что нейрогенез у животных усиливается в ответ на травматическое повреждение.
С помощью ИГХ- и ИФ-методов установлено, что в участках коры человека, расположенных по соседству с зоной травматического повреждения, возрастает уровень экспрессии маркеров нейральных стволовых клеток и клеток-предшественников (SOX2, Tuc4, NeuroD, DCX, PSA-NCAM) по сравнению с контролем. В тех же клетках выявляли маркеры пролиферации (Ki-67 и Mcm2), причем общее количество пролиферирующих нейральных стволовых клеток существенно возрастало после травматического повреждения. Исследование проводили на операционном материале от 11 пациентов (возраст 48—78 лет) [39].
Регуляция нейрогенеза
Сведения о факторах, оказывающих влияние на пролиферацию и дифференцировку нейрональных стволовых клеток и клеток-предшественников, отрывочны и крайне скудны.
Еще 1998 г. in vitro в опыте на человеческом фетальном нейроэпителии показан дозозависимый эффект bFGF на рост нейробластов, а также то, что под влиянием bFGF клетки приобретают веретеновидную форму, удлиняются, их отростки начинают ветвиться и активируются гены, ассоциированные с нейронами (усиливается синтез мРНК нейрофиламентов) [40]. Большие дозы bFGF способны блокировать нейрогенез [41].
M. Monje и соавт. [42] показали, что под влиянием химио- и лучевой терапии медуллобластомы и острого миелобластного лейкоза подавляется нейрогенез и возникает воспалительная микроглиальная реакция в гиппокампе человека. Исследование проводили на аутопсийном материале. Для ИГХ-исследования использовали маркеры нейроногенеза (DCX), пролиферирующих клеток (Ki-67), глиогенеза (Olig2) и микроглии (CD68). Количество вновь образованных нейронов (DCX+) в гиппокампе у пациентов, получавших химио- и лучевую терапию, уменьшалось в 10—100 раз по сравнению с контролем. Кроме того, после облучения в гиппокампе наблюдается увеличение количества CD68±клеток. При этом количество Olig2±клеток в контроле и после химиолучевой терапии осталось относительно неизменным.
Показано, что низкомолекулярные ингибиторы GSK-3 усиливают нейрогенез в культуре нейральных клеток-предшественников человека (линия ReNcell VM). Авторы [43] обрабатывали дифференцирующиеся нейральные клетки-предшественники ингибиторами GSK-3 и наблюдали изменения в активности GSK-3, GSK-3-опосредованного сигналинга (для этих целей использовали вестерн-блоттинг) и изменения в процессе дифференцировки клеток (ИГХ-окрашивание на βIII-тубулин и TUNEL). При обработке клеток ингибитором GSK-3 на 4-й день культивирования не выявлено разницы ни в плотности клеток в культуре, ни в количестве TUNEL±клеток. В то же время значительно возрастала пропорция нейронов в культуре — от 2,6% в контроле до 5,7 и 4,1% — под воздействием ингибиторов (SB216763 и kenpaullone соответственно). In vitro установлено, что антидепрессант сертралин усиливает нейрогенез в клетках гиппокампа человека путем активации глюкокортикоидного рецептора. Под воздействием антидепрессанта в культуре увеличивалось количество как незрелых нейробластов (DCX+), так и зрелых нейронов (MAP2+), причем эффект нивелировался антагонистом глюкокортикоидных рецепторов RU486. При этом пролиферация клеток-предшественников (исследовалась инкорпорация BrdU) увеличивалась только при воздействии сертралина вместе с агонистом глюкокортикоидных рецепторов дексаметазона, этот эффект также подавлялся под влиянием RU486. Для исследования использовали культуру гиппокампальных клеток-предшественников человека линии HPC03A/07 [44].
В исследовании in vitro показано, что цитокин интерлейкин-1β, уровень которого повышен у пациентов с депрессией, подавляет нейрональную дифференцировку в клетках-предшественниках гиппокампа человека. Интерлейкин-1β приводил к уменьшению количества как незрелых DCX±нейробластов, так и зрелых MAP2±нервных клеток. Однако вместе с тем интерлейкин-1β приводил к увеличению количества клеток, инкорпорирующих BrdU, что говорит об усилении пролиферации. Методом qPCR также установлено, что интерлейкин-1β вызывает повышение уровня экспрессии генов ферментов IDO (индоламиндиоксигеназа), KMO (кинуренинмонооксигеназа) и кинурениназы, которые задействованы в нейротоксической ветви метаболизма триптофана, причем использование ингибитора KMO подавляло негативный эффект интерлейкина-1β на нейрогенез. В исследовании [45] использовали культуру клеток гиппокампа человека линии HPC03A/07.
Группе отечественных авторов [46] при описании наблюдения 39-летней женщины с посттравматическим вегетативным состоянием удалось показать, что лечение ботулотоксином, А привело к восстановлению сознания и положительной динамике при ПЭТ-исследовании, четко коррелировавшем топографически с признаками нейрогенеза, которые оценивали по выявлению ИГХ нестина, Musashi1, PCNA, Ki67 и Tuc4.
Работ, посвященных нейрогенезу при нейроинфекциях любой этиологии, в литературе нет.
Выводы
1. В постнатальном нейрогенезе у человека участвуют субвентрикулярная зона, субгранулярная зона зубчатой извилины гиппокампа, стриатум и, возможно, обонятельные луковицы.
2. Как у животных, так и у человека пролиферативные процессы в нейрогенных зонах с возрастом становятся менее интенсивными, однако не исчезают совсем. Кроме того, в течение жизни изменяется иммуногистохимический профиль клеток субгранулярной зоны.
3. При инсульте у человека по периферии зоны некроза появляются нейральные стволовые клетки и клетки-предшественники, усиливается пролиферация и появляются молодые постмитотические нейроны. Однако на сегодняшний день вопрос о том, насколько полноценны их связи с другими нейронами и каково значение вновь образованных нейронов в восстановлении функции после инсульта, остается открытым.
4. В исследованиях на материале, полученном от человека, установлено, что при нейродегенеративных заболеваниях (Альцгеймера, Гентингтона и Паркинсона) происходит усиление нейрогенеза в ответ на потерю нейронов (в отличие от животных, у которых при моделировании нейродегенеративных заболеваний нейрогенез подавляется). При этом следует заметить, что, например, амилоидный β-пептид сам по себе подавляет пролиферацию и дифференцировку нейральных клеток-предшественников.
5. Как у животных, так и у человека нейрогенез при эпилепсии может быть как проявлением ответа нервной ткани на повреждение (т.е. попыткой репарации), так и одним из звеньев патологического процесса, который ответствен за образование эпилептогенных очагов.
6. Нейрогенез у человека при аддикциях (алкогольной, опиатной и др.), а также в условиях травматического повреждения требует дальнейшего изучения. При этом получены данные, что при моделировании алкогольной аддикции на грызунах происходит подавление нейрогенеза, а при исследовании головного мозга людей, страдавших хроническим алкоголизмом, статистически значимых различий в количестве пролиферирующих клеток по сравнению с контролем не обнаружено.
7. Влияние нейроинфекции на нейрогенез у человека не изучено.
8. На нейрогенез у человека могут влиять такие разнообразные факторы, как bFGF, GSK-3, интерлейкин-1β, ботулотоксин, а также химио- и лучевая терапия.
9. Факторы, способные активировать и подавлять нейрогенез, требуют дальнейшего подробного изучения, поскольку возможно их использование в терапевтических целях.
10. Данные о нейрогенезе под влиянием одних и тех же факторов (например, алкогольная аддикция, нейродегенеративные заболевания), полученные от человека и животных, могут существенно различаться.
Авторы заявляют об отсутствии конфликта интересов.