Экстраагглютинины анти а1 что такое
Экстраагглютинины анти а1 что такое
Подгрупповые факторы крови
Спустя примерно десятилетие после открытия так называемых групповых факторов крови было установлено что изоагглютиноген А по некоторым особенностям его серологических свойств является не однородным фактором. Так, с помощью специальных методов исследования было установлено, что отдельные образцы эритроцитов крови группы А(II) с различной интенсивностью извлекают (адсорбируют) фактор анти-А (а) из плазмы (или сыворотки) крови группы 0(I) или В (III), содержащих агглютинин анти-А. Наряду с этим обнаружены были факты весьма различной агглютинабильности эритроцитов, содержащих фактор А. С точки зрения указанных изоиммунологических особенностей фактора А можно было выделить по крайней мере две его разновидности: фактор А1, активно адсорбирующий фактор анти-А и вместе с тем легко доступный агглютинации, и фактор А2, вяло адсорбирующий фактор анти-А и одновременно трудно доступный агглютинации. Обе эти разновидности фактора А были обнаружены как в эритроцитах крови группы А(II), так и в эритроцитах крови группы AB(IV). Разновидности эти получили наименование подгрупп в силу того, что факторы А1 и А2, помимо некоторых различий, имеют и общие свойства, главное из которых заключается в том, что оба эти фактора адсорбируют агглютинин анти-А и агглютинируются этим фактором. В результате последующих, более углубленных исследований было установлено, что в сыворотке крови, относящейся к отдельным разновидностям группы А(II), нередко обнаруживаются особые, так называемые иррегулярные агглютинины или экстраагглютинины, дающие реакцию агглютинации с эритроцитами, относящимися к другой разновидности группы A(II). Taк, в сыворотке крови подгруппы А1(II) обнаруживается иногда экстраагглютинин аити-А2 (α1). а в сыворотке крови подгруппы А2 (II) иногда обнаруживается экстраагглютинин анти-A1 (α1). Эти экстраагглютинины чаще выявляются в сыворотке крови отдельных разновидностей группы АВ (IV), нежели группы А(II). При этом экстраагглютинин α2 встречается много чаще экстраагглютинина α2. Так, в сыворотке крови, относящейся к подгруппе А2В (IV), примерно в 25% случаев обнаруживается экстраагглютинин cti. В подгруппе A1B(IV) экстраагглютинин α2 отмечается гораздо реже, примерно в одном случае на 300-400 сывороток крови, относящейся к этой подгруппе. Следует также отметить, что сыворотка, содержащая фактор α2, обнаруживает свойство давать феномен агглютинации не только с эритроцитами подгруппы А2(II), но также и с эритроцитами группы 0(I); при этом под воздействием сыворотки, содержащей агглютинин α2, агглютинация с эритроцитами 0 наступает быстрее и настолько ярче, чем с эритроцитами А2, что агглютинин α2 многими серологами вполне обоснованно определяется и обозначается как агглютинин анти-0.
Открытие экстраагглютининов и их серологических особенностей свидетельствует о том, что так называемые погруппы представляют собой не только количественно, но и качественно различные варианты фактора А, приобретающие совершенно самостоятельное значение. Это открытие свидетельствует, таким образом, о том, что сложившийся в эволюции процесс внутривидовой иммунологической дифференциации, естественно, продолжается и что дифференциация внутригрупповая в такой же мере закономерна и специфична, как и дифференциация внутривидовая, и определяет собой в итоге индивидуализацию организмов во всем многообразии их общебиологических, морфологических и физиологических особенностей. Выявление экстраагглютининов и их иммунологических особенностей свидетельствует, в частности, о том, что эритроциты крови группы 0(I) также содержат по крайней мере один агглютиноген, имеющий определенное генетическое сродство с групповыми агглютиногенами, ближайшим образом с агглютиногеном А2.
На протяжении нескольких десятилетий внутригрупповая дифференциация обнаруживалась лишь в отношении фактора А в виде двух его разновидностей. В настоящее время установлен уже ряд разновидностей фактора А с нисходящей специфической активностью (A1-А2-А3 _ _ _Аn). В этом смысле фактор В характеризуется большей однородностью. Однако в настоящее время с несомненностью установлена комплексная структура и этого фактора. Фактически можно различать уже три подгрупповые разновидности фактора
В (B1-В2-В3). Обнаруживаемые обычной методикой исследования факторы А и В, как правило, состоят из нескольких подгрупповых разновидностей соответствующего группового фактора. Что касается антигена 0, то его иммунологическая дифференциация пока еще не установлена.
Опыт использования различных методов иммуногематологического тестирования крови доноров и реципиентов в условиях многопрофильного стационара
И.Я. Голоусиков¹, В.В. Данилец¹, О.Г. Панасенкова¹, Т.А. Правова1, Н.Г. Дашкова²
¹ ГБУЗ «Городская больница № 3 ДЗМ», г. Москва
² ГБОУ ВПО «Первый Московский государственный медицинский университет имени И.М. Сеченова» Минздрава России, г. Москва
Трансфузиология №2, 2015
Резюме
Иммуногематологические исследования образцов крови доноров и реципиентов в условиях многопрофильного стационара целесообразно проводить с использованием высокочувствительных и высокоспецифичных иммуногематологических методов, что обеспечит высокий уровень иммуногематологической безопасности гемокомпонентной терапии и позволит минимизировать риск посттрансфузионных реакций. Представлены данные сравнительного тестирования 20 326 образцов крови доноров и реципиентов различными методами иммуногематологического обследования: гемагглютинация на микропланшетах, твердофазная технология и гелевая технология с использованием карт различных производителей. При использовании твердофазной технологии «Capture-R» чаще выявлялся антиген А2 в группе наблюдения АВ(IV), а также Dw в группе наблюдения Rh – как у доноров, так и у реципиентов.
Ключевые слова: группы крови системы АВ0, резус-фенотип, донор, реципиент.
Введение
Проблеме оптимизации и улучшения качества иммуногематологического тестирования больных перед трансфузией донорских гемокомпонентов в отечественном здравоохранении уделяется повышенное внимание. Принятый в апреле 2013 года приказ Минздрава России № 183н «Об утверждении Правил клинического использования донорской крови и (или) ее компонен- тов» [1] внес существенные дополнения в алгоритм предтрансфузионного тестирования, регламентируя подбор идентичных эритроцитов донора и реципиента по 10 антигенам. В обязательном порядке регламентируется также скрининг аллоиммунных антител у реципиентов с использованием панели стандартных эритроцитов. Новые правила, расширяя спектр и увеличивая количество исследований, диктуют необходимость сравнения различных технологий и выбора наиболее чувствительных, информативных, экономически доступных методов иммуногематологического тестирования. В част- ности, представляет интерес сравнение использования твердофазной и ге- левой технологий. Единичные исследования, посвященные сопоставлениям различных технологий тестирования, проводились в США [2]. Сведения о подобного рода исследованиях в отечественной литературе отсутствуют.
Цель настоящей работы – оценить диагностическую значимость технологии гемагглютинации в микропланшетах и твердофазной технологии «Сapture» компании Immucor (США) и сравнить с двумя гелевыми технологиями – Bio-Rad (США) и Grifols (Испания).
Материалы и методы
За период с января по декабрь 2013 года на анализаторе «Galileo Neo» Immucor (CША) были проведены иммуногематологические исследования 20 326 образцов крови. Параллельно гелевыми методами Bio-Rad (США) и Grifols (Испания) протестировано 7073 образца крови доноров реципиентов, беременных женщин и рожениц. Исследования проводили в 2 этапа. Первый этап включал определение групп крови по системе АВ0 с идентификацией подгрупп (А2, В2), резус-принадлежности, выявление слабого варианта анти- гена D – DW и экстраагглютининов анти-А1. Второй этап заключался в проведении скрининга антиэритроцитарных аллоантител различными методами и установлении их специфичности. При работе методами Immucor (США) использовался полностью автоматический анализатор «Galileo Neo», моно- клональные сыворотки двух разных марок – «ImmuClon» и «NOVACLON» для определения антигенов системы АВ0, Rh, Kell, микропланшеты «Сapture-R» для выявления антиэритроцитарных антител, определения титра, стандартные эритроциты «Referenscells A (1), B» и другие материалы, предусмотренные технологией, в том числе контрольные.
Результаты
Результаты параллельного тестирования образцов крови по системе АВ0 и резус с использованием твердофазной и гелевой технологий приведены в табл. 1.
Как показали исследования, частота выявления антигена А2 и антигена В2 в группах наблюдений А (II) и В (III) при использовании всех трех методов существенно не различалась. Выявление антигена А2 в группе наблюдения АВ (IV) при использовании твердофазного метода было чаще, чем с использованием гелевой технологии (х² = 4,46, p
Выявление и подтверждение слабого варианта антигена D особенно важно при исследовании образцов крови доноров. Следует напомнить, что при определении резус-принадлежности у доноров и выявлении слабых вариантов антигена D донорские эритроциты относят к резус-положительным, что позволяет избежать сенсибилизации при переливании таких эритроцитсодержащих сред резус-отрицательным реципиентам [3, 4, 5, 6, 7]. Обращает на себя внимание тот факт, что при использовании твердофазной технологии в образцах крови с подгруппой A2B (IV) в 7 случаях, в том числе у 3 доноров, выявлены экстраагглютинины анти-А1, тогда как с помощью технологии Bio-Rad экстраагглютинины обнаружены только в одном образце, а с использованием Grifols не выявлены ни в одном образце.
Результаты скрининга антител при параллельном тестировании образцов крови тремя методами приведены в табл. 2.

Как следует из табл. 2, антиэритроцитарные аллоантитела были выявлены у 0,6–0,9% обследованных лиц. Фенотипирование антигенов эритроцитов и выявление аллоиммунных антиэритроцитарных антител – необходимые составляющие для обеспечения иммуногематологической совместимости крови донора и реципиента при гемотрансфузиях [1, 3, 4, 6–8]. Ошибки при проведении исследований антигенов эритроцитов и антиэритроцитарных антител могут быть результатом как нарушения технологии, так и применения неадекватных схем диагностики [4, 6, 9].
Неправильное заключение о наличии или отсутствии антигенов и аллоиммунных антител у доноров и реципиентов повышает риск развития пост-трансфузионных осложнений гемолитического типа [5, 9]. Выбор высокочувствительных и высокоспецифичных иммуногематологических методов позволит обеспечить высокий уровень иммуногематологической безопасности гемокомпонентной терапии и минимизировать риск посттрансфузионных реакций [7, 10].
Заключение
Современные автоматизированные варианты классических методов иммуногематологического тестирования (гемагглютинация на микропланшетах, твердофазная технология) и гелевые технологии эффективно используются при исследовании крови доноров и различных категорий реципиентов. Полученные результаты показали преимущество технологии Immucor при выявлении экстраагглютининов анти-А1 у доноров и реципиентов подгрупп А2В (IV), а также антигена DW по сравнению с гелевыми технологиями.
Литература
1. Приказ Министерства здравоохранения Российской Федерации от 02.04.2013 г. № 183н «Об утверждении правил клинического использования донорской крови и (или) ее компонентов». – М., 2013. – 26 с.
2. Issitt P.D., Anstee D.J. Applied Blood Group Serology. – 4-th ed. – Durham, NC, USA: Montgomery Sc. Publ., 1998. – 1208 p.
3. Иммуносерология (нормативные документы) / Составит. А.Г. Башлай, С.И. Донсков. – М.:ВНИИТИ, 1998. – 196 с.
4. Донсков С.И., Мороков В.А. Группы крови человека: Руководство по иммуносерологии. – М.: ИП Скороходов В.А., 2011. – 1016 с.
5. Косяков П.Н. Изоантигены и изоантитела человека в норме и патологии. – М.: Медицина, 1974. – 360 с.
6. Рагимов А.А., Дашкова Н.Г. Основы трансфузионной иммунологии. – М.: Медицинское информационное агентство, 2004. – С. 279–283.
7. Скудицкий А.Е. Профилактика посттрансфузионных осложнений, обусловленных групповыми антигенами эритроцитов: автореф. дис. … канд. мед. наук. – М., 2001. – 26 с.
8. Weisbach V., Kohnhauser T., Zimmerman R. et al. Comparison of the performance of microtube column systems and solid-phase systems and the tube low-ionic-strength solution additive indirect antiglobulin test in the detection of red cell alloantibodies // Transfus. med. – 2006. – Vol. 16, № 4. – P. 276–284.
9. Минеева Н.В. Антитела к антигенам эритроцитов и методы их выявления: Методические рекомендации. – СПб., 2000. – 14 с.
10. Умнова М.А. Изосерологические системы крови человека и их значение в трансфузиологии // Групповые системы крови и гемотрансфузионные осложнения / Под ред. проф. М.А. Умновой. – М.: Медицина, 1989. – С. 5–30.
Экстраагглютинины анти а1 что такое
а) Антигенность вызывает иммунные реакции крови. При первых попытках переливания крови от человека к человеку часто немедленно или с задержкой происходила агглютинация и гемолиз эритроцитов, в результате развивались трансфузионные реакции, часто приводившие к смерти. Вскоре открыли, что кровь разных людей имеет разные антигенные и иммунные свойства, поэтому антитела в плазме одной крови реагируют с антигенами на поверхностях эритроцитов другого типа крови. При соответствующих мерах предосторожности всегда можно заранее определить возможность реакции между антителами и антигенами крови донора и реципиента при переливании.
Множественность антигенов клеток крови. В клетках крови человека, особенно на поверхностях их мембран, обнаружено, по крайней мере, 30 часто встречающихся антигенов и сотни других редких антигенов, каждый из которых может при случае вызвать реакцию антиген-антитело. Большинство антигенов слабые и, следовательно, принципиально важны для изучения наследования генов при установлении близкого родства (отцовство, материнство, происхождение).
Два основных типа антигенов гораздо чаще, чем другие, могут вызывать трансфузионные реакции крови. Это система антигенов 0-А-В и система Rh.
Группы крови системы антигенов 0-А-В
а) Антигены А и В — агглютиногены. Два антигена — тип А и тип В — встречаются на поверхностях красных клеток крови у большой части людей. Именно с этими антигенами (также называемыми агглютиногенами, поскольку они часто вызывают агглютинацию клеток крови) связано большинство трансфузионных реакций крови. В связи со способом наследования этих агглютиногенов на клетках людей могут или отсутствовать оба антигена, или присутствовать оба одновременно, или один из них.
б) Основные группы крови в системе 0-А-В. При переливании крови от одного человека другому кровь доноров и реципиентов в норме подразделяют на 4 основные группы по системе 0-А-В в зависимости от наличия или отсутствия агглютиногенов А и В. Если нет агглютиногенов ни А, ни В, кровь относят к группе 0. Если присутствует только агглютиноген А, кровь относят к группе А, если присутствует только агглютиноген В — к группе В, когда присутствуют оба агглютиногена — к группе АВ.
Два гена, по одному на каждой из двух спаренных хромосом, определяют тип крови в системе 0-А-В. Существуют 3 типа этих генов — тип 0, тип А или тип В, но только один из них может присутствовать на каждой из двух хромосом. Ген типа 0 практически не функционирует, т.е. он не вызывает определенного типа агглютиногена 0 на клетках. Наоборот, гены типа А и типа В формируют сильные агглютиногены на клетках.
Как показано в таблице выше, возможны 6 комбинаций генов: 00, 0А, 0В, АА, ВВ и АВ. Эти комбинации генов известны как генотипы, и каждый человек имеет 1 из 6 генотипов.
Из таблицы выше легко понять, что человек с генотипом 00 не имеет агглютиногенов и, следовательно, его группа крови 0. Человек с генотипом 00 не имеет агглютиногенов и, следовательно, его группа крови 0. Человек с генотипами 0А или АА имеет агглютиногены типа А, следовательно, его группа крови А. Генотипы 0В и ВВ дают кровь группы В, а генотип АВ — группу крови АВ.
в) Относительная распространенность разных типов крови. Изучение распространенности разных групп крови среди определенной группы людей дало следующий приблизительный результат.
Агглютинины
Если красные клетки крови человека не имеют агглютиногена типа А, в его плазме крови развиваются антитела, известные как анти-А агглютинины. При отсутствии агглютиногена типа В в плазме развиваются антитела, известные как анти-В агглютинины.
Снова обратившись к таблице выше, отметим, что группа крови 0, хотя и не имеет агглютиногенов, содержит и анти-А, и анти-В агглютинины; группа крови А содержит агглютиногены типа А и анти-В агглютинины; группа крови В содержит агглютиногены типа В и анти-А агглютинины. Наконец, группа крови АВ содержит и А, и В агглютиногены, но не имеет в плазме агглютининов.
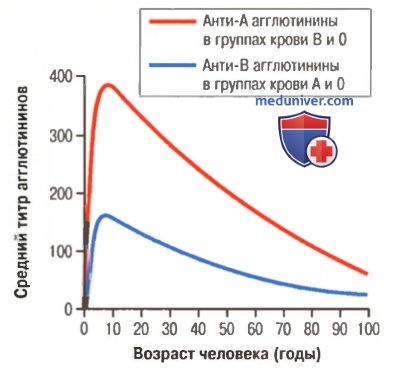
а) Титр агглютининов в разном возрасте. Сразу после рождения количество агглютининов в плазме практически равно нулю. Через 2-8 мес после рождения у ребенка начинается продукция агглютининов: анти-А агглютининов — при отсутствии А агглютиногенов в клетках, и анти-В агглютининов — при отсутствии В агглютиногенов. На рисунке выше показано изменение титра анти-А и анти-В агглютининов с возрастом. Максимальный титр обычно достигается к возрасту 8-10 лет и постепенно снижается в течение остальных возрастных периодов жизни.
б) Происхождение агглютининов плазмы. Агглютинины, как почти все антитела, являются гамма-глобулинами и формируются теми же клетками костного мозга и лимфатических желез, которые создают антитела к любым другим антигенам. Большинство агглютининов являются иммуноглобулинами IgM и IgG.
Но почему эти агглютинины формируются у людей, не имеющих соответствующих агглютиногенов в их эритроцитах? Ответом на этот вопрос является тот факт, что небольшое количество антигенов типа А и В попадает в организм с пищей, бактериями и другими путями, и эти вещества инициируют развитие анти-А и анти-В агглютининов.
Например, введение антигена группы А реципиенту, в крови которого нет этого антигена, вызывает типичный иммунный ответ с формированием большего количества анти-А агглютининов, чем присутствует постоянно. Практическое отсутствие агглютининов у новорожденного также доказывает, что их образование осуществляется почти полностью после рождения.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
— Вернуться в оглавление раздела «Физиология человека.»
Определение группы крови
В 1901 году выдающийся ученый Карл Ландштейнер открыл группы крови и заложил основы современной трансфузиологии. Исследователь выявил три группы на основании различных вариантов реакции агглютинации эритроцитов и сывороток крови. Материал для исследования был взят у сотрудников собственной лаборатории. Ученики Ландштейнера Декастелло и Стюрли несколькими годами позже открыли четвертую группу, но посчитали ее сомнительной и исключили из результатов исследований. В 1906 году психиатр из Праги Ян Янский подтвердил существование группы AB (IV). Публикация исследования в местном издании оказалась практически незамеченной. В 1910 году после повторного обнаружения четвертой группы Моссом Ян Янский был вынужден доказывать первенство открытия. Чешский ученый предложил цифровое обозначение групп крови: I, II, III, IV.
В трансфузиологии группами крови называют различные сочетания антигенов эритроцитов. Антигены являются генетическими признаками: наследуются от родителей и остаются неизменными на протяжении жизни. В 1980 году Международное сообщество переливания крови разработало числовую терминологию для антигенов эритроцитов. Выделены 23 системы группы крови, включающие 194 антигена. Нумерация в большинстве случаев соответствует порядку обнаружения. Входящие в каждую из 23 систем антигены кодируются шестизначным номером: первые три цифры являются номером системы, оставшиеся три – указывают на специфичность антигена внутри системы.
| № системы | Наименование | Обозначение | Наименование генов | Хромосомная локализация |
|---|---|---|---|---|
| 001 | AB0 | AB0 | AB0 | 9q34.1—q34.2 |
| 002 | MNS | MNS | GYPA, GYPB, GYPE | 4q28—q31 |
| 003 | P | P1 | P1 | 22q11.2—qter |
| 004 | Rh | RH | RHD, RHCE | 1p36.2—p34 |
| 005 | Lutheran | LU | LU | 19q12—q13 |
| 006 | Kell | KEL | KEL | 7q33 |
| 007 | Lewis | LE | FUT3 | 19p33 |
| 008 | Duffy | FY | FY | 1q22—q23 |
| 009 | Kidd | JK | JK | 18q11—q12 |
| 010 | Diego | DI | AE1 | 17q12—q21 |
| 011 | Yt | YT | ACHE | 7q22 |
| 012 | Xg | XG | XG | Xp22.32 |
| 013 | Scianna | SC | SC | 1p36.2—p22 |
| 014 | Dombrock | DO | DO | неизвестна |
| 015 | Colton | CO | AQP1 | 7p14 |
| 016 | Landsteiner-Wiener | LW | LW | 19p13.2—cen |
| 017 | Chido/Rogers | CH/RG | C4A, C4B | 6p21.3 |
| 018 | Hh | H | FUT1 | 19q13 |
| 019 | Kx | XK | XK | Xp21.1 |
| 020 | Gerbich | GE | GYPC | 2q14—q21 |
| 021 | Cromer | CROM | DAF | 1q32 |
| 022 | Knops | KN | CR1 | 1q32 |
| 023 | Indian | IN | CD44 | 11p13 |
Система группы крови AB0
Групповая принадлежность по системе AB0
По мере движения с запада на восток Евразии частота обнаружения антигена A падает, а антигена B возрастает. Антиген 0 редко встречается в Азии, но имеет широкое распространение у коренных народов Южной Америки, Полинезии и Австралии. Причина – эпидемии инфекционных заболеваний.
Результат типирования крови записывают в историю болезни или в карту донора. Врач-трансфузиолог указывает дату и ставит подпись.
В отдельных случаях во время типирования наблюдается слабовыраженная агглютинация эритроцитов. Недостаточно выраженная реакция объясняется наличием слабых вариантов антигенов A и B. Наибольшее клиническое значение представляют подгруппы A1 и A2. Впервые слабые варианты были обнаружены в 1911 году учеными Dungern и Hirszeld. Позднее в 1930 году Landsteiner и Levine предложили названия подгруппы – A1 и A2. A2 встречается до 20 % в группе A и до 35 % в группе AB. Сыворотка лиц из образцов крови A2 может содержать анти-A1-антитела: в 2 % случаев в группе A2 и в 30 % в A2B. Антитела анти-A1 представляют опасность ввиду агглютинации эритроцитов группы A.
Методика определения групп крови A2 и A2B
Частота выявления эритроцитов A2 существенно варьируется в зависимости от применяемых реагентов. Приводим сравнение результатов исследования при использовании различных методик типирования групп крови A2 и A2B.
| Число проанализированных образцов | Группа крови A (II) | Группа крови AB (IV) | ||
|---|---|---|---|---|
| Число проанализированных образцов | Группа A2 (II) в % | Число проанализированных образцов | Группа A2B (IV) в % | |
| Анти-A1 (лектин, фитогемагглютинин) | 1592 | 14,7 | 357 | 23,5 |
| Цоликлоны: анти-A, анти-AB | 3599 | 2,1* | 357 | 7,03* |
| Цоликлон анти-А — слабый | 3587 | 4,5* | 357 | 11,2* |
| Стандартные изогемагглютинирующие сыворотки | 1592 | 17,4 | 344 | 34,2 |
Примечание: * — агглютинация выражена слабо, присутствуют мелкие агглютинаты на розовом фоне.
Наибольшую точность исследования обеспечивает Анти-A1 (лектин, фитогемагглютинин). Тест рекомендован для выявления подгрупп антигена A у детей младше двух лет. Причина – физиологическая незрелость эритроцитов новорожденных, влекущая ошибочные результаты исследования со стандартными изогемагглютинирующими сыворотками.
В 1930 году Landsteiner и Levine обнаружили подтип Aint: промежуточный вариант между A1 и A2. Данный антиген характерен для негроидов и достигает 8,5 % у лиц с группой крови A. У европеоидов Aint наблюдался лишь у 1 % людей со второй группой крови. В крайне редких случаях у человека отсутствуют все антигены системы AB0. Фенотип «Бомбей» обусловлен генотипом hh. При отсутствии антигена H у лиц данной категории обнаруживаются анти-A и анти-B антитела.
Методика определения групп крови
Алгоритм выявления группы крови гемагглютинирующими сыворотоками
Для определения группы крови AB0 прямым методом используют две серии стандартных изогемагглютинирующих сывороток. Подготовьте две серии сывороток трех групп с титром 1:32 или выше. Для забора каждой сыворотки используйте отдельную маркированную пипетку. Подготовьте сыворотку AB(IV) для контроля.
В последнем случае следует удостовериться в отсутствии неспецифической реакции: нанесите на планшет 2 – 3 капли соответствующей группе AB(IV) сыворотки и добавьте одну каплю анализируемых эритроцитов. Перемешайте жидкости и оцените результат спустя пять минут. Отсутствие агглютинации свидетельствует о принадлежности к группе AB(IV), наличие – признак неспецифической реакции. В этом случае, а также при слабовыраженной агглютинации повторите исследование с другими сериями сывороток.
Техника определения группы крови цоликлонами
Моноклональные антитела к антигенам эритроцитов пришли на смену изогемагглютинирующих сывороток. Для каждого типирования достаточно одной серии реагентов анти-A, анти-B, анти-AB. Внедрение моноклональных реагентов позволило значительно упростить и стандартизировать методику типирования по системе AB0. Приводим краткое пошаговое руководство проведения исследования на планшете.
Обычно реакция обнаруживается уже в первые секунды после смешивания. При этом слабые варианты антигенов A и B могут давать более позднюю агглютинацию.
Непрямой метод типирования: алгоритм действий
Методика определения основана на взаимодействии эритроцитов от предварительно типированных лиц групп 0, A, B или смеси эритроцитов от нескольких одногруппных доноров с изогемагглютининами α и β в исследуемой сыворотке.
При работе с каждым типирующим реагентом используйте сухие чистые пипетки. Промывание палочек для перемешивания и пипеток осуществляйте в 0,9 % растворе NaCl.
Заключение о групповой принадлежности
| Результаты анализа плазмы со стандартными эритроцитами | Групповая принадлежность | ||
|---|---|---|---|
| 0(I) | A(II) | B(III) | |
| — | + | + | 0(I) |
| — | — | + | A(II) |
| — | + | — | B(III) |
| — | — | — | AB(IV) |
Система Резус
Levine и Stetson обнаружили антигены системы Резус в 1939 году. Ученые изучали причины развития гемолитических реакций у рожениц при трансфузиях женщинам идентичных по системам AB0, MN и P. эритроцитов мужей. Годом позже Landsteiner и Wiener продуцировали выработку антител посредством иммунизации кроликов эритроцитами обезьян макака-резус. Антитела получили название анти-RH антитела. Полученные агглютинины вступали в реакцию агглютинации с эритроцитами макак-резус и с эритроцитами 85 % граждан Нью-Йорка белой расы. Вызвавший образование антител антиген получил название RH-фактор (D-фактор).
В редких случаях эритроциты людей не содержат ни одного антигена резус. Фенотип обозначают Rhnull. Ген Xro в этом случае представлен в гомозиготной форме и подавляет продуцирование всех антигенов. Обладатели фенотипа Rhnull не проявляют агглютиногеной активности, но имеют возможность передавать антигены по наследству.
Среди европейцев частота резус-положительных по антигену D лиц составляет 85 %. На мембране красных кровяных телец обычно расположено около 10 000 – 30 000 молекул D. При этом существуют два особых типа D-положительных лиц: D u (слабый) и D partial (частичный). Иммунная система D u и D partial способна вырабатывать анти-D-антитела.
Слабый антиген встречается у 1,5 % резус-положительных лиц и характеризуется низким числом (100 – 500) молекул D на мембране. Является иммуногенным для резус-отрицательных лиц. При этом переливание D-положительных эритроцитов больным со слабым D может вызвать сенсибилизацию кровяных телец донора. Эритроциты с D u слабо агглютинируются или совсем не вступают в прямую реакцию агглютинации с полными анти-резус антителами. Определение резус-принадлежности производят в непрямом антиглобулиновом тесте. Носителей D u считают резус-положительными донорами и резус-отрицательными реципиентами.
Антитела против антигенов резус являются иммунными. Возникают вследствие изосенсибилизации. Специфичность определяется спровоцировавшими образование антител антигенами. Выделяют полные и неполные антитела.
Полные являются IgM антителами. Отличаются большим молекулярным весом, обнаруживаются реже по сравнению с неполными антителами. Способны агглютинировать резус-положительные эритроциты. Имеют меньшее значение при трансфузиях.
Неполные преимущественно относятся к классу IgG. Закрепляются на поверхности резус-положительных эритроцитов без образования агглютинатов. Склеивание кровяных телец осуществляется при наличии коллоидных растворов и протеолитических ферментов или после обработки антиглобулиновой сывороткой. Обладают меньшим в сравнении с полными антителами молекулярным весом. Способны проходить через плаценту. Во время сенсибилизации сперва продуцируются полные антитела, далее в большей мере вырабатываются неполные (иммуноглобулины IgG) антитела.
Техника выявления резус-фактора с использованием цоликлона Анти-D-Супер
В случае наступления реакции кровь оценивается как резус-положительная (Rh+), при отсутствии реакции – как резус-отрицательная (Rh-). При отрицательной либо слабо выраженной агглютинации необходимо повторно провести исследование с неполными анти-D IgG антителами с целью выявления слабого или частичного антигена D.
Методика определения резус-фактора D u в пробирочном тесте
Параллельно с анализом выполняют постановку трех контрольных проб: реагента цоликлон Анти-D (анти-D IgG) со стандартными резус-положительными и резус-отрицательными эритроцитами, анализируемых эритроцитов с раствором желатина без диагностикума анти-D IgG.
Отсутствие результатов реакции с анти-D IgM и выраженная агглютинация с анти-D IgG свидетельствуют об обнаружении слабых форм антигена D. При слабо выраженной агглютинации следует повторить исследование в непрямой пробе Кумбса.
Определение резус-принадлежности стандартным универсальным реагентом
Стандартный реагент антирезус Rh0D содержит поликлональные неполные анти-D-антитела. Параллельно с анализом образца осуществляется контрольное исследование реагента Rh0D со стандартными резус-положительными (одногруппными или группы 0) и резус-отрицательными (одногруппными) эритроцитами.
Результат считается достоверным только после проверки контрольных образцов: наступлении реакции со стандартными резус-положительными и отсутствии реакции – с резус-отрицательными эритроцитами.
Информацию о пошаговой постановке непрямого теста Кумбса с использованием неполных анти-D-антител читайте в разделе сайта «Реакция Кумбса».


















