Шизоциты в крови что это значит у женщин
Шизоциты в крови что это значит у женщин
Морфологическое исследование эритроцитов, лейкоцитов, тромбоцитов и подсчет лейкоцитарной формулы производят в окрашенных мазках крови.
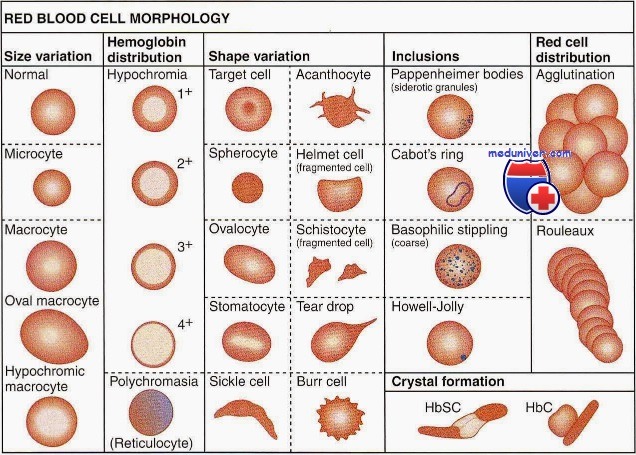
Качественная оценка эритроцитов имеет большое диагностическое и прогностическое значение. Обязательным является определение размеров и формы эритроцитов, их окраски, наличия и степени анизоцитоза и пойкилоцитоза, наличия патологических форм эритроцитов и включений в них.
При отсутствии автоматического анализатора для определения размеров эритроцитов измеряют их средний диаметр с построением эритроци-тометрической кривой Прайс-Джонса (гистограмма распределения эритроцитов по размеру). Диаметр нормальных эритроцитов в мазке равен 7-8 мкм, средний диаметр — 7,55 мкм.
Эритроциты размером более 8 мкм называются макроцитами (большие эритроциты с сохраненным просветлением в центре), более 12 мкм — мегалоциты или гигантоциты (гигантские эритроциты без просветления в центре). Эритроциты диаметром менее 6,5 мкм называются микроцитами, менее 2-3 мкм — шизоцитами. В норме в периферической крови выявляется 15,5% микроцитов и 16,5% макроцитов.
При использовании автоматического анализатора клеток крови проводится определение среднего объема эритроцитов (MCV), в зависимости от которого различают микроциты (MCV менее 75 мкм3), нормоциты (MCV в пределах 75-95 мкм3) и макроциты (MCV более 95 мкм3). На основании среднего объема эритроцитов строится эритроцитометрическая кривая.
Клиническое значение морфологического исследования клеток крови
При микроцитозе 30-50% от общего числа эритроцитов составляют микроциты. Микроцитоз наблюдается при ряде наследственных анемий (талассемии, гемоглобинопатии, микросфероцитоз, серповидноклеточная анемия, атрансферринемия, врожденная форма сидеробластной анемии).
Сдвиг эритроцитометрической кривой влево (увеличение количества эритроцитов малого диаметра) наблюдается при многих приобретенных анемиях (железодефицитные анемии, анемия хронических заболеваний, анемии при отравлении свинцом и др.).
При макроцитозе 50% и более от общего числа эритроцитов составляют макроциты. Макроцитоз чаще всего наблюдается при В12- и фолиеводефицитной анемиях.
Увеличение количества эритроцитов разного размера в мазке крови называется анизоцитозом. Это ранний признак анемии, наблюдающийся при ее легкой степени. Выделяют три степени анизоцитоза, которые обозначаются цифрами 1, 2 и 3.
Степень анизоцитоза эритроцитов (RDW — the Red cell Destribution Width) в современных гематологических анализаторах определяется автоматически. У здоровых людей большая часть эритроцитов (68%) представлена нормоцитами; микроциты составляют около 15%, макроциты — 17%. В норме RDW колеблется от 9,9 до 14,5%. При увеличении количества эритроцитов разного размера RDW нарастает.
В мазке крови большинство эритроцитов имеет округлую форму и только малая часть (до 10%) отличается по своей форме. Увеличение количества эритроцитов разной формы называется пойкилоцитозом. При этом эритроциты могут становиться овальными, грушевидными, звездчатыми, зазубренными и др.
Пойкилоцитоз является результатом продукции патологических клеток костным мозгом либо развивается вследствие повреждения нормальных клеток после выхода их из костного мозга в кровяное русло. Присутствие некоторых специфических форм эритроцитов (микросфероцитоз, эллиптоцитоз, стоматоцитоз) в большем количестве по сравнению с нормой имеет важное диагностическое значение.
Выделяют три степени пойкилоцитоза, которые также обозначаются цифрами 1, 2 и 3. Как и анизоцитоз, пойкилоцитоз является неспецифическим признаком любой анемии и отражает ее степень. Однако, в отличие от анизоцитоза, пойкилоцитоз появляется только при выраженной анемии и имеет более неблагоприятное прогностическое значение.
Эритроциты здоровых людей являются нормохромными, т. е. имеют равномерную окраску и небольшое (не более 1/3 диаметра клетки) просветление в центре. Гипохромия — увеличение центральной неокрашенной части эритроцита больше нормы. В зависимости от размеров просветления выделяют три степени гипохромии (1, 2, 3).
Усиленная окраска эритроцитов называется гиперхромией. Гиперхромия обусловлена увеличением объема эритроцитов и обычно сочетается с макроцитозом и мегалоцитозом. Более интенсивно окрашиваются микросфероциты.
В норме эритроциты окрашиваются кислыми красками, но молодые эритроциты с остатками ядерной субстанции (ретикулоциты) могут окрашиваться основными, приобретая различные оттенки серовато-сиреневого, серовато-фиолетового или серовато-голубого цвета. Эти клетки называются полихроматофилами. Полихроматофилия (полихромазия) — показатель усиленной регенерации костного мозга (наблюдается при гемолитических и постгеморрагических анемиях). В зависимости от числа полихроматофилов в поле зрения различают три степени полихромазии (1, 2, 3).
При различных состояниях в мазке крови могут обнаруживаться патологические формы эритроцитов (ядросодержащие — нормоциты), а также внутриэритроцитарные включения ядерного и цитоплазматического происхождения. Ядросодержащие эритроциты (синонимы: эритрокариоциты, нормоциты) в значительном количестве встречаются при гемолитических анемиях (прежде всего — гемолитическом кризе) и остром эритромиелозе (М6 по FAB-классификации).
Умеренный нормоцитоз наблюдается при постгеморрагических анемиях, сублейкемическом миелозе и метастазах злокачественных опухолей в костном мозге. Единичные нормоциты могут встречаться при В12-дефицитной анемии, миелодиспластических синдромах, хроническом миелолейкозе.
Среди внутриэритроцитарных включений ядерного происхождения различают тельца Жолли (круглые включения сине-фиолетового или вишнево-красного цвета диаметром 1-2 мкм), кольца Кебота (остатки ядерной оболочки в форме тонких нитеобразных колец, «восьмерки» или эллипса, окрашенные в красный цвет) и пылинки Вейденрейха (мелкая азурофильная, иногда голубая зернистость, чаще обнаруживается в мегалоцитах). Ядерные включения свидетельствуют о неэффективном эритропоэзе и встречаются при В12-дефицитных и гемолитических анемиях.
Кроме того, эритроциты с тельцами Жолли появляются после спленэктомии и при функциональной гипосплении и асплении у больных хроническими миелопролиферативными заболеваниями.
К внутриэритроцитарным включениям цитоплазматического происхождения относится базофильная пунктация (зернистость), которая представляет собой патологическую преципитацию вещества рибосом, перерожденных митохондрий и сидеросом и выглядит как точечная зернистость темно-синего цвета различной величины. Эритроциты с базофильной пунктацией встречаются при токсическом повреждении костного мозга (отравления свинцом, цинком, ртутью и др.), ряде анемий (талассемии, мегалобластные анемии), миелодиспластических синдромах и являются неблагоприятным прогностическим признаком.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Тромботическая микроангиопатия в акушерстве
Введение
Преэклампсия и HELLP-синдром являются грозным осложнением беременности. В настоящее время они рассматриваются как варианты тромботической микроангиопатии (ТМА). Наиболее грозным представителем ТМА является атипичный гемолитико-уремический синдром (аГУС), к развитию которого предрасполагают генетические аномалии в системе иммунитета. Установлено, что беременность сама по себе может активировать патологический иммунный ответ, причем выраженность активации возрастает при наличии акушерских осложнений, достигая максимума у пациенток с преэклампсией. Генетический дефект в сочетании с преэклампсией приводит к неконтролируемой активации иммунного ответа, являющегося при акушерском аГУС основой развития полиорганной недостаточности, которая не может быть устранена без специфического лечения.
Критерии диагноза ТМА
ТМА представляет собой синдром, в основе которого лежит повреждение эндотелия сосудов микроциркуляторного русла (МЦР) различными способами, но имеющий сходные проявления и диагностические признаки. Результатом эндотелиального повреждения служит тромботическая микроангиопатия — особый тип поражения мелких сосудов, представленный их тромбозом и воспалением сосудистой стенки.
Морфологическая картина ТМА: отек эндотелиальных клеток, их отслойка от базальной мембраны (эндотелиоз), некроз, деструкция, расширение субэндотелиального пространства, тромбы в просвете капилляров и артериол, содержащие тромбоциты и фибрин, нередко с полной окклюзией просвета сосудов.
Клинико-лабораторные признаки ТМА:
Тромботические микроангиопатии классифицируют на первичные и вторичные.
Вторичные ТМА вследствие следующих состояний:
Критерии диагноза аГУС в акушерстве
Диагноз аГУС в акушерстве — это диагноз исключения. Дифференциальная диагностика с другими формами ТМА приведена в табл. 1.
Положительный результат при бактериологическом исследовании кала: посев на среду для выявления STEC (Mac Conkey для 0157:Н7), определение в образцах фекалий ДНК энтеро-геморрагических E.coli методом ПЦР; выявление в сыворотке антител к липополисахаридам наиболее распространенных в данном регионе серотипов E.coli.
Наследственная или приобретенная ТТП
Дефицит ADAMTS-13 — активность менее 10%, антитела к ADAMTS-13
Беременность. Исключить преэклампсию и HELLP-синдром
Ферменты печени, срок гестации, критерии преэклампсии и тяжелой преэклампсии, положительная динамика непосредственно после родоразрешения
Аутоиммунные заболевания (системная красная волчанка, антифосфолипидный синдром)
Анти-ДНК-антитела, антинуклеарные антитела, антитела к кардиолипину IgG и/или IgM изотипов, антитела к (32 GP 1 IgG и/или IgM изотипов с помощью стандартизованного иммуноферментного метода, волчаночный антикоагулянт стандартизованным коагулологическим методом
Положительные результаты иммунного блоттинга на ВИЧ- инфекцию
Наличие очага инфекции и полиорганной недостаточности (острое изменение по шкале SOFA >2 баллов)|
Генетическое исследование и биопсия почки не являются необходимыми для установления диагноза аГУС и не играют роли для решения вопроса о тактике лечения больного.
Преэклампсия и HELLP-синдром являются специфическими ассоциированными с беременностью формами ТМА. Всем пациенткам, госпитализированным с диагнозом тяжелая преэклампсия и/или HELLP-синдром, необходимо до родоразрешения исследовать ЛДГ, гаптоглобин в сыворотке крови и шизоциты в мазке периферической крови, а также определить количество тромбоцитов и уровень креатинина.
Истинные тяжелая преэклампсия и HELLP-синдром требуют родоразрешения с целью элиминации секретирующегося анти-ангиогенного фактора sFlt-1 плаценты.
Поскольку термин «HELLP-синдром» — собирательное понятие и его причины до конца не выяснены, тактика родоразрешения и интенсивной терапии строится в соответствии с тактикой при тяжелой преэклампсии (родоразрешение). В этом случае диагноз формулируется в соответствии с МКБ Х — «Тромботическая микроангиопатия (HELLP-синдром)».
Принципы и схемы терапии
При развитии клиники HELLP-синдрома в послеродовом периоде необходимо строить тактику интенсивной терапии в зависимости от следующих клинических вариантов:
Вариант 1. У пациентки сохранены: сознание, диурез более 0,5 мл/кг/ч (вне зависимости от цвета мочи), стабильная гемодинамика (или с тенденцией к артериальной гипертензии), отсутствует геморрагический синдром любой локализации. При лабораторном исследовании выявлены тромбоцитопения, повышены уровни АСТ, АЛТ, ЛДГ, массивного внутрисосудистого гемолиза нет. Плазменные факторы свертывания в норме. В данном случае, в течение суток оценивается динамика клинико-лабораторных
проявлений HELLP-синдрома и при отсутствии отрицательных проявлений интенсивная терапия ограничивается базовой терапией преэклампсии и инфузией кристаллоидов Пациентка получает нутритивную поддержку и активизируется. Проводится тромбопрофилактика НМГ при количестве тромбоцитов более 70000 в мкл.
Вариант 2. Уже с первых часов после родоразрешения развивается клиника острой печеночной недостаточности (тромбоцитопения, рост АСТ, АЛТ, коагулопатия, кровотечение, шок, ОПН, ОРДС и т.д.), в основе, которой лежит некроз печени (подкапсульная гематома). Требует проведения комплексной посиндромной интенсивной терапии острой печеночной недостаточности в условиях многопрофильного ЛПУ с возможностью хирургического лечения.
Вариант 3. Развитие массивного внутрисосудистого гемолиза (свободный гемоглобин в крови и моче, анемия) уже в первые часы осложняется развитием ОПН (по шкалам RIFLE, AKIN, KDIGO) и требует проведения заместительной почечной терапии. Противопоказано применение магния сульфата и инфузионной терапии. Требует проведения комплексной посиндромной интенсивной терапии ОПН в условиях многопрофильного ЛПУ. При сохранении или прогрессировании симптомов ТМА (тромбоцитопения и МАГА) в течение 48 часов следует, как один из вероятных диагнозов рассматривать аГУС и проводить соответствующую терапию.
Вариант 4. В исключительных случаях верификации диагноза ТТП в послеродовом периоде на основании сочетания признаков HELLP-синдрома, нарастающей тромбоцитопении, симптомов поражения почек и/или ЦНС со снижением активности ADAMTS-13 менее 10% показана инфузия свежезамороженной плазмы и проведение плазмообмена«.
Вариант 5. Женщинам, перенесшим акушерскую ТМА (преэклампсия, HELLP-синдром), следует устанавливать диагноз аГУС, если после родоразрешения их состояние не улучшается или ухудшается, в короткие сроки приводя к формированию
полиорганной недостаточности, что свидетельствует о персистировании ТМА с генерализацией микроангиопатического процесса.
В первую очередь о возможном аГУС следует думать при развитии тяжелого HELLP-синдрома с признаками внепеченочного поражения, особенно если родоразрешение не сопровождается положительной динамикой состояния пациентки, несмотря на лечение в соответствии с клиническими рекомендациями (протоколом лечения) МЗ РФ «Гипертензивные расстройства во время беременности, в родах и послеродовом периоде. Преэклампсия. Эклампсия» 2016 г. Быстрое нарастание анемии при отсутствии выраженной кровопотери свидетельствует об усилении микроангиопатического гемолиза, что, как правило, сопровождается усугублением тромбоцитопении и стремительным ухудшением функции почек, приводящим к развитию олигурической.
Родильницам с установленным диагнозом аГУС следует назначать патогенетическую терапию, направленную на блокирование С5-компонента системы комплемента, играющего ключевую роль в развитии данного осложнения. Антикомплементарная терапия проводится согласно рекомендациям по лечению аГУС взрослых.
Экулизумаб — рекомбинантное гуманизированное моноклональное антитело класса Ig G к С5 компоненту комплемента. Препарат блокирует расщепление С5, препятствуя образованию мембрано-атакующего комплекса и предотвращая тем самым повреждение эндотелия и, следовательно, прекращая процессы микроциркуляторного тромбообразования. Применение Экулизумаба приводит к обратному развитию ТМА и/или предупреждает прогрессирование поражения почек. Критериями эффективности терапии Экулизумабом являются прекращение микроангиопатического гемолиза (снижение уровня ЛДГ до нормальных значений) и нормализация числа тромбоцитов, а также улучшение функции почек.
Начальный курс терапии Экулизумабом рассчитан на 5 недель, далее подразумевается переход на цикл поддерживающего лечения.
Индукционный курс: 1 раз в неделю вводят по 900 мг Экулизумаба на протяжении недель. На пятой неделе дозу увеличивают до 1200 мг.
Поддерживающий этап: каждые 14 (плюс/минус 2 дня) дней вводят по 1200 мг.
В ожидании Экулизумаба родильницы с установленным диагнозом аГУС должны получать в случае необходимости почечную заместительную терапию при наличии ОПН. Свежезамороженная плазма в больших объемах у пациенток с тяжелой преэклампсией может вызвать перегрузку объемом (TACO-синдром) или развитие иммунного TRALI-синдрома и в отсутствие клинических проявлений коаулопатии и кровотечения противопоказана! Свежезамороженная плазма применяется только при верификации диагноза ТТП.
Состояние здоровья человека напрямую зависит от количества данных форменных элементов. Для того чтобы определить их количество, назначают общий анализ крови. С помощью полученных результатов можно наблюдать течение болезни и характер воспалительных процессов, которые могут протекать в организме. Также общий анализ крови назначают при появлении таких симптомов, как усталость, постоянные головные и мышечные боли, утомляемость.
Для чего назначают общий анализ крови?
Кровь в организме человека выполняет ряд важных функций, поэтому ее состав очень информативен при диагностике возможных заболеваний. Чаще всего во время планового обследования назначается общий анализ крови. При подозрительных результатах назначается развернутый биохимический анализ.
Процедура сдачи общего анализа крови
Перед визитом в клинику не рекомендовано принимать пищу. Также в течение нескольких дней следует прекратить прием медикаментов (только по рекомендации врача). Процедура проводится утром. Забор крови делают из пальца или вены.
Таблица – Нормы общего анализа крови для взрослых
Из таблицы выше следует что, нормы анализа крови у мужчин и женщин отличаются. Во время беременности также изменяются показатели анализа крови.
Гемоглобин
Гемоглобин – это белок, в составе которого имеются ионы железа. Он отвечает за дыхательную функцию крови и производит газообмен между клетками организма.
Если у человека обезвоживание организма, сердечная недостаточность; имеются проблемы с пищеварением, вследствие чего была рвота и диарея – то анализ покажет пониженный уровень гемоглобина.
При повышенном уровне речь идет о закупорке сосудов за счет того, что кровь становится гуще. Из-за этого образуются тромбы, что повышает риск развития сердечно-сосудистых заболеваний.
После рассмотрения результатов анализов должно быть подобрано соответствующее лечение для улучшения показателей. Самолечение в данном случае недопустимо.
Эритроциты
Если человек испытывает стресс, сидит на изнуряющих диетах, которые сочетаются с высокими физическими нагрузками, то уровень эритроцитов будет понижен.
Для коррекции происходящих в организме нарушений назначаются лекарства. Препарат должен быть подобран врачом с учетом результатов проведенных исследований и особенностей организма пациента.
Если при расшифровке биохимического анализа крови СОЭ выше нормы, то это говорит о том, что в организме идут инфекционные и воспалительные процессы, также возможны онкологические заболевания.
Снижение уровня СОЭ свидетельствует о болезнях, сопровождающиеся изменениями формы эритроцитов, например серповидно-клеточная анемия.
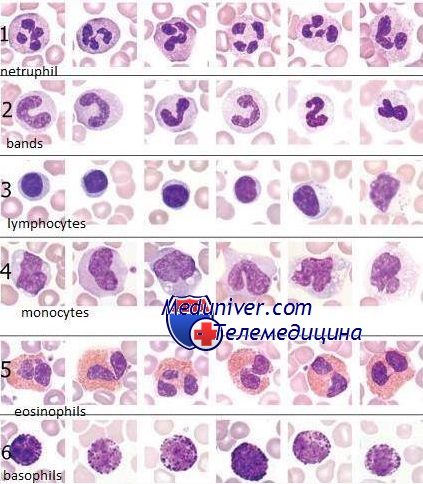
Лейкоциты
В норме общее количество лейкоцитов в крови находится в диапазоне 4х109/л до 1,1х1010 /л. Лейкоциты – это форменные элементы крови. Если количество выше нормы, то это указывает на то, что в организме происходит воспалительный процесс. Причины повышения лейкоцитов могут быть следующие: острые инфекции, онкологические заболевания, острое и хроническое воспаление.
Чтобы осуществить подсчет процентного соотношения лейкоцитов разных видов в лабораторной диагностике используют лейкоцитарную формулу. Если из результатов биохимического анализа крови видно, что идет сдвиг лейкоцитарной формулы влево, это значит, что в крови находятся незрелые нейтрофилы. Хотя в норме они должны быть только в костном мозге.
Тромбоциты
Образование тромбоцитов идет в красном костном мозге. Норма у женщин составляет 170,0-320,0х109/л и у мужчин 180,0-320,0х109/л.Туберкулез, рак печени и почек, острые инфекции, отравления, стресс провоцируют повышенное содержание тромбоцитов при расшифровке общего анализа крови.
Пониженное содержание тромбоцитов при расшифровке анализа наблюдается при частом приеме лекарственных препаратов. Низкий уровень тромбоцитов наблюдается также у людей, страдающих алкоголизмом. Если при расшифровке показателей анализа у женщин наблюдается низкий уровень тромбоцитов, то это может говорить о затяжных менструациях.
Гематокрит
При расшифровке биохимического анализа крови особое место выделяют такому показателю, как гематокрит. Он указывает на отношение объема клеток крови к общему объему крови и выражается в процентах.
У женщин низкий уровень гематокрита может говорить о наступлении беременности. Биохимические исследования крови являются важным показателем при установке диагноза пациента и назначении лечения. Сдавать общий анализ крови рекомендовано не только при возникновении недомоганий, но и в целях диагностики организма на отсутствие болезней.
Интерпретация полученных результатов проводится на приеме у врача, который назначил анализ. Специалист учитывает половую принадлежность и возраст пациента. На основании полученных данных врач разрабатывает индивидуальную схему лечения.
Самостоятельная расшифровка полученных результатов может привести к получению ложного представления о диагнозе. Без определенных знаний невозможно определить состояние здоровья даже при наличии результатов анализа крови. Доверяйте расшифровку результатов лабораторных исследований опытным специалистам.
Диагностика и лечение хронической аутоиммунной гемолитической анемии
Больная Ш., 80 лет, пенсионерка. Из анамнеза известно, что в течение последних двух лет неоднократно проходила амбулаторное и стационарное лечение по поводу хронической B12–фолиеводефицитной анемии, диагностированной на основании анемического синдрома в сочетании с гиперхромией и макроцитозом эритроцитов. Стернальная пункция, определение уровня витамина B12 и фолиевой кислоты не проводились. Отмечался временный незначительный положительный эффект лечения витамином B12. С конца 2011 года, несмотря на ежемесячное введение витамина B12 в дозе 500γ в сочетании с фолиевой кислотой, стала нарастать анемия (14.02.2012 г. гемоглобин – 54 г/л). Для обследования и лечения госпитализирована в больницу № 40 с диагнозом: B12–фолиеводефицитная анемия тяжелой степени. ИБС. Стенокардия напряжения II ф. к. Гипертоническая болезнь II ст. Желчнокаменная болезнь. Хронический калькулезный холецистит. Мочекаменная болезнь. Конкремент правой почки, простые кисты обеих почек. Полипы желудка.
При поступлении жалобы на выраженную общую слабость, головокружения, головную боль, учащенное сердцебиение, перебои в работе сердца.
При объективном осмотре отмечены субиктеричность кожи и слизистых оболочек, умеренная гепатомегалия (+2 см) и спленомегалия (+ 2 см).
Результаты клинического анализа в динамике представлены в таблице 1.
Таблица 1. Клинические анализы крови пациентки Ш. в динамике
 |  | 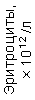 | 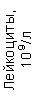 | 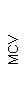 | 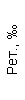 |  | 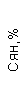 | 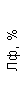 | 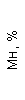 | 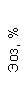 | 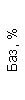 | 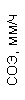 |
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 15.02.12 | 54 | 1.39 | 10.5 | 133 | 80 | 2 | 66 | 21 | 9 | 2 | — | 75 |
| 11.03.12 | 50 | 1.41 | 11.8 | 114 | 98 | 4 | 75 | 11 | 4 | 3 | 1 | 78 |
| 15.03.12 | 49 | 1.31 | 17.8 | 121 | 288 | 4* | 60 | 23 | 5 | 1 | — | 78 |
| 20.03.12 | 72 | 1.93 | 11.4 | 116 | 297 | 2 | 73 | 14 | 7 | 2 | 0 | 46 |
| 27.03.12 | 66 | 1.9 | 11 | 108 | 202 | 2 | 60 | 26 | 7 | 3 | 0 | 40 |
| 12.04.12 | 70 | 1.75 | 1.9 | 112 | 104 | 3 | 62 | 24 | 11 | 0 | 0 | 27 |
| 26.04.12 | 93 | 2.56 | 5.7 | 109 | 148 | 3 | 74 | 13 | 9 | 0 | 0 | 11 |
| 24.06.12 | 111 | 3.42 | 4.7 | 97 | 7 | 2 | 69 | 21 | 10 | 0 | 1 | 15 |
| 16.08.12 | 120 | 3.97 | 5.8 | 93 | 12 | — | 71 | 19 | 9 | 1 | 0 | 40 |
Примечание: * в лейкоцитарной формуле 15.03.12 выявлялись также миелоциты (2%) и метамиелоциты (5%).
В биохимическом анализе крови – повышение уровня креатинина (189 ммоль/л), билирубина (58 ммоль/л) за счет непрямого билирубина.
УЗИ органов брюшной полости: гепатоспленомегалия; камни желчного пузыря; диффузные изменения поджелудочной железы; простые кисты обеих почек, конкремент правой почки.
ФГДС: два полипа желудка размером до 0,5 см.
Учитывая высокий риск сердечно-сосудистых осложнений у пожилой пациентки с анемией тяжелой степени, проведены трансфузии эритроцитарной взвеси. На основании клинико-лабораторных данных (спленомегалия, гипербилирубинемия, гиперхромная анемия с ретикулоцитозом) и неэффективности лечения витамином B12 и фолиевой кислотой заподозрена гемолитическая анемия.
При исследовании крови на антиэритроцитарные антитела выявлены аутоантитела класса IgG ++++.
Результаты стернальной пункции представлены в таблице 2.
Таблица 2.Миелограмма пациентки Ш. от 17.02.12 г.
Заключение
Клеточный костномозговой пунктат. Эритропоэз – нормобластический. Гиперплазия эритроидного ростка – 74,8%. Со стороны эритрокариоцитов отмечаются клетки с цитоплазматическими мостиками, скопления в виде «эритроидных островков».
Мегакариоциты различной степени зрелости с умеренным тромбоцитообразованием.
На основании данных миелограммы (гиперплазия эритроидного ростка при нормобластическом типе кроветворения) и выявления антиэритроцитарных антител диагностирована аутоимунная гемолитическая анемия с тепловыми антителами. При дополнительном обследовании признаков вторичного характера анемии не выявлено.
С 11.03.12 г. начата пульс-терапия метипреднизолоном в дозе 500 мг 1 раз в день внутривенно в сочетании с пероральным приемом преднизолона в дозе 45 мг в сутки под прикрытием гастропротекторов. После 5 дней лечения анемический синдром продолжал нарастать, появился выраженный сдвиг лейкоцитарной формулы влево, увеличение количества ретикулоцитов (табл.1). Доза преднизолона перорально увеличена до 75 мг в сутки, к лечению добавлен азатиоприн по 100 мг/сутки per os, проведена трансфузия1 дозы эритроцитарной взвеси.
С 20.03.12 г. с учетом сохраняющегося гемолиза (ретикулоциты 297‰) проведен второй курс пульс-терапии метилпреднизолоном в дозе 500 мг в сутки № 4, однократно введен внутривенно циклофосфан в дозе 600 мг.
Лечение больная переносила хорошо. С 27.03.12 г. отмечена тенденция к увеличению уровня гемоглобина без поддерживающих гемотрансфузий. Решено продолжить введение циклофосфана по 200 мг в сутки, отменить азатиоприн. Анемический синдром продолжал уменьшаться: к 12.04.12 г. уровень гемоглобина достиг 70 г/л, снизился гемолиз (ретикулоцитов 104‰), однако развилась лейкопения (1,9×10 9 /л), в связи с чем циклофосфан был временно отменен. После восстановления количества лейкоцитов лечение циклофосфаном по 200 мг дважды в неделю было возобновлено на фоне постепенного снижения дозы преднизолона.
Больная в удовлетворительном состоянии 28.04.12 г. выписана из стационара. На амбулаторном этапе продолжено введение циклофосфана по 200 мг в сутки 2 раза в неделю, преднизолон в течение месяца полностью отменен.
В течение нескольких месяцев получала поддерживающую терапию циклофосфаном по 200 мг в сутки 2 раза в неделю (суммарная доза составила 7200 мг). На этом фоне уровень гемоглобина стабилен в пределах 100–120 г/л, количество ретикулоцитов не превышает 20%.
Комментарий к клиническому случаю
Аутоиммунная гемолитическая анемия (АИГА) – гетерогенная группа заболеваний и синдромов, обусловленных повышенным разрушением эритроцитов вследствие образования аутоантител. Частота АИГА во всех возрастных группах составляет 1:40000 – 1:80000, причем женщины болеют в 2 раза чаще мужчин. Выделяют первичные (идиопатические) и вторичные АИГА, которые чаще всего развиваются при лимфомах, солидных опухолях и заболеваниях соединительной ткани. По серологическим свойствам различают АИГА с тепловыми (85%) и холодовыми (15%) антителами; по месту разрушения эритроцитов выделяют АИГА с внутриклеточным (наиболее частым), внутрисосудистым и смешанным гемолизом.
Клинические проявления АИГА:
При внутрисосудистом гемолизе моча приобретает темно-бурую или черную окраску.
Лабораторные критерии:
Стандарт первой линии терапии АИГА – пероральные глюкокортикостероиды в начальной дозе 1 мг/кг в сутки, возможно проведение пульс-терапии метилпреднизолоном в дозе 0,5–1,0 г/сутки внутривенно в течение 3-5 дней. Второй линией терапии является спленэктомия, которая используется при отсутствии эффекта глюкокортикостероидов в течение 4–6 месяцев. У пожилых пациентов показано назначение иммунодепрессивных и цитостатических препаратов (азатипоприн, циклофосфон, циклоспорин). Значительно реже используют моноклональные антитела (ритуксимаб) и иммуноглобулин. Выживаемость больных АИГА в течение 5 лет составляет 75%.
При анализе данного случая обращает внимание длительное латентное течение заболевания у больной преклонного возраста с гиперхромной анемией, что послужило причиной ошибочного диагноза B12–дефицитной анемии (для АИГА характерен нормохромный характер анемии). С учетом возраста пациентки и наличия сопутствующих заболеваний было принято решение о подключении к лечению цитостатической терапии, позволившее получить ремиссию заболевания, отменить глюкокортикостероиды и отказаться от проведения спленэктомии.